|
|
| |
ALTRI DOCUMENTI
|
|||
Gli Orbitali ibridi[1]
L'Ibridizzazione prende origine dal fatto che un legame covalente o un lone pair[2] sono zone dello spazio elettricamente cariche.
Inoltre l'ibridizzazione è un ulteriore strumento per determinare la forma geometrica delle molecole.
Ciascuna di tale zona tende a orientarsi rispetto alle altre in modo che le distanze siano massime in modo da avere la minima repulsione e il contenuto di energia sia minimo nel loro insieme.
L'ibridizzazione è una trattazione matematica mediante la quale orbitali di tipo diverso (s , p , d) di uno stesso atomo e con contenuti di energia poco diversi, vengono dapprima mescolati tra loro e poi ridivisi in numero di orbitali uguale a quello degli orbitali puri di partenza, imponendo la condizione che questi nuovi orbitali (ORBITALI IBRIDI) siano isoenergetici.[3]
Rispetto agli orbitali atomici cui derivano una concentrazione delle nubi elettroniche in definite direzioni dello spazio e in essi uno dei due lobi che rappresentano la disposizione spaziale di carica è maggiore dell'altro; questi addensamenti di carica consentono maggiori ricoperture, e gli orbitali ibridi formano quindi legami più forti che non gli orbitali semplici da cui derivano.
Per chiarire il concetto di orbitale ibrido prendiamo in esempio il metano (CH4):
la configurazione elettronica esterna dell'atomo di carbonio ( C ) nel suo stato fondamentale è 2s2 2p2
dalla sua configurazione esterna si potrebbe quasi dire che l'atomo di C potrebbe fare solo 2 legami covalenti tanti quanti sono i suoi elettroni spaiati nell'orbitale p; invece l'atomo di c forma 4 legami covalenti assolutamente equivalenti tra loro (isoenergetici).
Il fatto che l'atomo di c formi 4 legami covalenti deriva dal fatto che esso scinde il lone pair 2s promovendo un elettrone 2s2 a un elettrone 2p, passando dallo stato fondamentale allo stato eccitato.
Ciò spiega come il carbonio riesca a form 646f53g are 4 legami covalenti e come i legami C-H siano assolutamente isoenergetici
Che tre di questi legami siano isoenergetici si potrebbe giustificare considerando che provengono dai 3 orbitali 2p, ma il quarto legame dovrebbe essere di energia diversa provenendo dall'orbitale 2s. Ciò viene superando ammettendo l'ibridizzazione dell'orbitale 2s e dei tre 2p in 4 orbitali ibridi sp3.
IBRIDIZZAZIONE sp
Deriva dal mescolamento di un orbitale s e di uno p dello stesso atomo, con lo stesso numero quantico n, questi formano fra loro un angolo di 180°, cioè sono allineati in posizione simmetrica rispetto al nucleo, tale disposizione garantisce la minima repulsione. (struttura lineare)
IBRIDAZZIONE sp2
Deriva dal mescolamento di un orbitale s e di due orbitali p dello stesso atomo, con lo stesso numero quantico n.
I tre orbitali ibridi cosi formati risulteranno a 120° fra loro e quindi considerando il nucleo dell'atomo al centro di un triangolo equilatero, gli orbitali sp2 sono diretti verso i vertici di tale triangolo. (struttura trigonale planare)
IBRIDIZZAZIONE sp3
Deriva dal mescolamento di un orbitale s e di 3 p con lo stesso valore n.
I quattro orbitali ibridi sp3 formano tra loro un angolo di 109,5° e sono diretti verso i vertici di un tetraedro il cui nucleo dell'atomo occupa il centro.
(struttura tetraedrica regolare
Esempi di ibridizzazione sp, sp2, sp3:
BeCl
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
BCl3
![]()
![]()
![]()
![]()
CCl4
![]()
![]()
![]()
Legenda:
![]()
![]()
![]()
orbitale s orbitale p orbitale ibrido
IBRIDIZZAZIONE sp3d
Deriva dal mescolamento e successiva equiripartizione dell'energia contenuta in un orbitale s, tre orbitali p e uno d, chiaramente di uno stesso valore quantico principale.
L'ibridizzazione a sp3d avviene solo per quegli atomi che hanno un numero quantico da 3 in su, deriva dalla promozione di un elettrone 3s a elettrone 3d.
La struttura geometrica che forma è quella di una bipiramide trigonale con tre angoli di 120°, sul piano
del triangolo e gli altri di 90°.
Un esempio di tale ibridizzazione è il PCl5
IBRIDIZZAZIONE sp3d2
Anche questo orbitale ibrido deriva da un mescolamento di un orbitale s, tre p e di de orbitale d, tutti col medesimo numero quantico principale.
Anche qui questo orbitale ibrido avviene per quegli atomi con numero quantico dal 2 in su.. E consiste nello sdoppiamento del lone pair dell'orbitale 3s e dell'orbitale 3p, che vendono promossi entrambi su 2 orbitale d.
La struttura che si ottiene da tale ibridizzazione è quella ottaedrica.
L'ibridizzazione degli orbitali rende conto anche di alcune anomalia riguardante la loro geometria molecolare presenti in alcune molecole, tra questi principalmente le molecole dell'acqua (H2O) e dell'ammoniaca (NH3)
Anche per l'ossigeno bisogna supporre che avvenga un ibridizzazione dell'orbitale s con i tre orbitale p con la formazione di 4 orbitali sp3, due dei quali ospitano un lone pair, mentre gli altri due ospitano un elettrone spaiato ciascuno, che accoppiandosi con i due elettroni dei 2 idrogeni dovrebbero formare come tutti gli orbitali sp3 un angolo di legame di 109°, come previsto da una disposizione tetraedrica.
L'angolo di circa 104°, corrisponde a una disposizione tetraedrica distorta giustificata dal fatto che i 2 orbitali ibridi contenenti i lone pair, esercitano una repulsione maggiore sugli elettroni impegnati nei legami H-O
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Lone pair
Struttura della molecola di H2O e NH3


![]()
![]()
 ~104°
~104°
![]()
![]()
![]()
![]() 107°
107°
![]()
![]()
![]()
![]()
ETENE C2H4
Attraverso l'ibridizzazione del carbonio otterremo 3 orbitali ibridi sp2 mentre un elettrone rimarrà nell'orbitale puro p.
Pertanto esisterà un doppio legame [ H2C = CH2 ] e ciascun atomo c formerà 2 legami covalenti (s ) con 2 atomi H e un terzo legame covalente s nel doppio legame.
L'ibridizzazione di ciascun atomo di c è quindi del tipo sp2 e la molecola si presenterà con una geometria trigonale piana.
I due elettroni che si trovano ciascuno nell'orbitale puro p interagiranno tra loro formando un legame p[5]
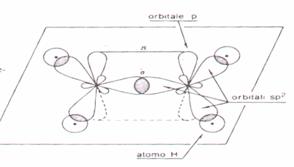 Figura etene
in forma di orbitali
Figura etene
in forma di orbitali
formula di struttura dell'etene (etilene)




![]()
![]()
![]()
![]()
![]()
![]()
ETINO C2H2
Attraverso l'ibridizzazione del c avremo 2 orbitali ibridi sp e 2 orbitali puri p con un elettrone ciascuno.
Pertanto esisterà un triplo legame[6] [ HC ≡ CH ] e ciascun atomo C formerà un legame covalente s con un atomo H e un legame covalente s nel triplo legame, i due orbitali puri p formeranno tra loro 2 legami p.. (molecola lineare)
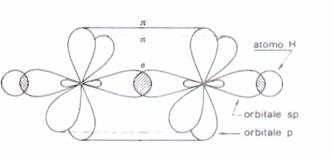 Figura molecola di etino in forma di orbitale
Figura molecola di etino in forma di orbitale
Formula di struttura dell'etino

BENZENE C6H6
Nella molecola di benzene i 6 atomi C sono disposti ai vertici di un esagono regolare e ciascuno di essi è legato ai 2 atomi di c adiacenti e con l'atomo di H, con orbitali di legame a 120° fra loro, ciò indica che ciascuno dei 6 atomi di c impegna in tali legami 3 dei suoi 4 orbitali esterni ibridizzati sp2.
L'orbitale p puro, contiene il 4 elettrone esso è ortogonale al piano della molecola.
Poiché i 6 atomi C sono ai vertici di un esagono regolare ciascun orbitale puro p ed a uguale distanza dai 2 orbitali puri p degli atomi c adiacenti e la probabilità di ricoprirsi con l'uno o con l'altro di essi ( attraverso legami p) è uguale nei due casi.
Si può per tanto dire che la molecola di benzene RISUONI fra le 2 forme canoniche energeticamente equivalenti:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
FRECCIA DI RISONANZA[7]
![]()
Convenzionalmente però la molecola di benzene la si può rappresentare anche come un esagono con al centro un cerchietto, che sta appunto ad indicare il legame tra gli elettroni degli orbitali puri p

![]()
IBRIDO DI RISONANZA
![]()
![]()
Il legame s (sigma) in genere è un legame semplice, esso avviene quando tra due atomi si ha luogo a una compenetrazione degli orbitali 1s (RICOPERTURA); la zona di ricopertura che è a elevata densità di carica negativa, costituisce l'elemento legante tra i due nuclei positivi.
La zona di ricopertura si trova lungo la congiungente i 2nuclei ed è compreso in questa congiungente appunto il legame s tale legame generalmente è formato dalla ricopertura di 2orbitali di tipo s, ma in altre molecole tale legame risulta formato dalla ricopertura di 2 orbitali di tipo diverso ma sempre contenente 1 solo elettrone per parte.
Il legame p si forma in quelle molecole tipo quella di azoto N2, gli orbitali p risultano essere perpendicolari tra loro, 2 orbitali p uno per ciascun atomo di n si ricopriranno tra loro lungo la congiungente dei 2 nuclei dando vita a un legame s, mentre gli altri orbitali p si deformeranno tra loro dando vita a ricoperture che non si trovano nella congiungente i nuclei ma su piani ortogonali che si intersecano lungo detta congiungente.
Pertanto il legame p si ha quando la zona di ricopertura di due orbitali si trova al di fuori della congiungente i due nuclei.
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2025