|
|
| |
Esperienza III: Titolazione complessometrica
per determinare la durezza di un'acqua
Durante la terza esperienza in laboratorio abbiamo misurato la durezza di un campione d'acqua prelevato in zona San Paolo (Roma) la mattina stessa, mediante una soluzione di EDTA.
Per durezza dell'acqua intendiamo la concentrazione, più o meno elevata, di due tra i principali ioni p 444e49e resenti in essa, Ca2+ e Mg2+. La presenza di questi ioni è dovuta al fatto che, a partire dalla sorgente, lungo il proprio cammino, l'acqua scorre su rocce contenenti CaCO3; questa specie chimica, in presenza di CO2 che impartisce acidità, si scioglie nel liquido (come nelle acque effervescenti) secondo la reazione:
CaCO3(s) + CO2 + H2O Ca2+ + 2HCO3-
Considerati singolarmente, il carbonato di calcio si dissocia in ioni e il diossido di carbonio in acqua forma bicarbonato:
![]() CaCO3(s) Ca2 aq)
+ CO32-(aq)
CaCO3(s) Ca2 aq)
+ CO32-(aq)
![]()
![]() CO2
+ H2O H2CO3 H+ + HCO3-
CO2
+ H2O H2CO3 H+ + HCO3-
Un'acqua "dura", a causa della deposizione dei sali di calcio e magnesio, quando questi ioni sono molto concentrati, può causare problemi sia a livello fisiologico, provocando l'accumulo di CaCO3 nei reni, sia a livello industriale, con la diminuzione dell'efficienza dei saponi.
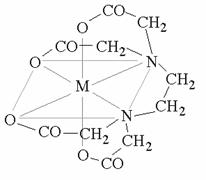
Per tale esperienza abbiamo utilizzato un complessante
ottaedrico esadentato, l'EDTA (Acido Diammino Tetra Acetico), dato che tale molecola forma dei complessi di coordinazione (composti formati da un
atomo o uno ione centrale, circondato da leganti, ioni o molecole, che forniscono
legami dativi) in cui si avvolge intorno a uno ione bivalente. Può avere sei
posizioni complessanti, quindi gli ioni che può legare sono tenuti insieme da
sei leganti, assumendo una conformazione spaziale ottaedrica. L'EDTA in forma
pura si trova sotto forma di sale bisodico diidrato, in cui due dei quattro
acidi acetici risultano essere deprotonati, andando a formare acetato di sodio:
![]()
![]() HOOC-CH2 CH2-COO- ∙∙∙
Na+
HOOC-CH2 CH2-COO- ∙∙∙
Na+
![]()
![]() 2H2O
∙∙∙∙ N-CH2-CH2-N
2H2O
∙∙∙∙ N-CH2-CH2-N
![]()
HOOC-CH2 ![]()
![]() CH2-COO- ∙∙∙
Na+
CH2-COO- ∙∙∙
Na+
Grazie a questo complessante abbiamo effettuato una titolazione che ci ha permesso di determinare dapprima la durezza totale dell'acqua, ovvero [Ca2+] + [ Mg2+], e in un secondo momento la concentrazione dei soli ioni Ca2+.
L'esperienza si può distinguere in tre fasi:
o preparazione del complessante EDTA e della soluzione contenente il campione;
o determinazione della durezza totale;
o determinazione della [Ca2+].
Preparazione dell'EDTA e della soluzione contenente il campione
Il PM è uguale al Peq dato che i reagenti
reagiscono in proporzioni stechiometriche uguali
Per
prima cosa abbiamo calcolato il PM dell' EDTA disodico diidrato, al fine di
determinare i grammi necessari per preparare 1l di una soluzione 0,01M:
PM = (10x12) + (2x14) + (1x18) + (10x16) + (2x23) + 18 = 372 uma
P = Peq x M x V = 372uma x 0,01M x 1l = 3,72g
Questi grammi di EDTA sono stati solubilizzati con H2O distillata. Dopo aver agitato la soluzione con una bacchetta di vetro, solubilizzandola completamente, e dopo averla travasata con un imbuto nel matraccio da 1l, è stato raggiunto tale volume con l'aggiunta delle acque di lavaggio del becher e di altra acqua distillata. Con l'aiuto di un imbuto, abbiamo travasato all'interno di una buretta circa 50ml del liquido.
![]() In una beuta abbiamo versato mediante una
pipetta tarata, precedentemente avvinata, 25ml del campione di H2O,
più 5ml di un tampone ammoniacale, avente un pH≈10 e quindi un pOH
compreso tra 4 e 5, NH4+/NH3 (formato da una base debole,
con pKNH pari a 1,8x10-5, e dal sale
dell'acido forte). L'ambiente basico così ottenuto ha consentito la
deprotonazione dell'EDTA (che solo in questa forma può complessare gli ioni
contenuti nel campione) senza però provocare la precipitazione di Mg2+.
Al tutto abbiamo aggiunto l'indicatore nero eriocromo T, una sostanza organica
colorata che può fungere da legante polidentato e che reagisce con gli ioni
secondo la reazione: Ind+Ca2+ CaInd2-n. Dopo aver versato
cinque gocce di eriocromo, la soluzione ha assunto una colorazione fucsia:
questo è il colore in cui l'indicatore si presenta in forma indissociata, cioè
quando forma un complesso con gli ioni calcio e magnesio. Questo complesso deve essere meno stabile di quello
che deriva dall'EDTA, in modo che l'Acido Diammino Tetra Acetico sarà in grado
di sottrarre gli ioni all'indicatore nel momento in cui avrà legato tutti gli
ioni Ca2+ e Mg2+ liberi in soluzione.
In una beuta abbiamo versato mediante una
pipetta tarata, precedentemente avvinata, 25ml del campione di H2O,
più 5ml di un tampone ammoniacale, avente un pH≈10 e quindi un pOH
compreso tra 4 e 5, NH4+/NH3 (formato da una base debole,
con pKNH pari a 1,8x10-5, e dal sale
dell'acido forte). L'ambiente basico così ottenuto ha consentito la
deprotonazione dell'EDTA (che solo in questa forma può complessare gli ioni
contenuti nel campione) senza però provocare la precipitazione di Mg2+.
Al tutto abbiamo aggiunto l'indicatore nero eriocromo T, una sostanza organica
colorata che può fungere da legante polidentato e che reagisce con gli ioni
secondo la reazione: Ind+Ca2+ CaInd2-n. Dopo aver versato
cinque gocce di eriocromo, la soluzione ha assunto una colorazione fucsia:
questo è il colore in cui l'indicatore si presenta in forma indissociata, cioè
quando forma un complesso con gli ioni calcio e magnesio. Questo complesso deve essere meno stabile di quello
che deriva dall'EDTA, in modo che l'Acido Diammino Tetra Acetico sarà in grado
di sottrarre gli ioni all'indicatore nel momento in cui avrà legato tutti gli
ioni Ca2+ e Mg2+ liberi in soluzione.
Determinazione della durezza totale
Abbiamo quindi iniziato la titolazione aggiungendo l'EDTA contenuto nella buretta: inizialmente il colore non è cambiato molto, perché erano presenti più ioni Ca2+ e Mg2+ in forma libera; quando la soluzione è virata da rosa fucsia a blu, abbiamo interrotto l'erogazione chiudendo il rubinetto della buretta. Il cambiamento di colore è dovuto al fatto che l'indicatore era in forma dissociata, dal momento che tutti gli ioni si sono "staccati" da esso, preferendo reagire con l'EDTA. Ciò significa che è stata raggiunta l'equivalenza ed è avvenuta la reazione:
Y4- + Ca2+ → CaY2- Y4- =EDTA deprotonato
I risultati ottenuti effettuando tre volte l'operazione sono stati: V1 = 8,4ml, V2 = 8,6ml, V3 = 8,4ml, con Vm =(V1+V2+V3)/3 = 8,46ml. Da cui:
M(Ca2++Mg2+) = (MEDTA*VEDTA)/V(Ca2++Mg2+) = (0,01*8,46)/2,5 = 3,38*10-3 mM
1 F°→10mg/l di CaCO3 PMCaCO = 100uma
Quindi abbiamo convertito il risultato in gradi
francesi:
![]() M*PMCaCO3*1000 = 3,38*10-3*102*102 = 33,8 F°
M*PMCaCO3*1000 = 3,38*10-3*102*102 = 33,8 F°
I gradi francesi si misurano così, considerando gli ioni calcio e magnesio come fossero tutti Ca2+ e assumendo che gli ioni Ca2+ corrispondono a CaCO3.
Determinazione della concentrazione di calcio
Per determinare solo la concentrazione di Ca2+ del campione, abbiamo aggiunto a 25ml della nostra acqua 1ml di soluzione preparata con 2g di NaOH, sciolto in 10ml di H20 distillata; ciò ha provocato un ambiente basico avente pH=14, che ha consentito la precipitazione degli ioni Mg2+, sottraendoli così dall'ambiente di reazione (in modo da far reagire successivamente con l'EDTA solo gli ioni Ca2+):
Mg2+ + 2OH- → Mg(OH)2↓
Al tutto sono stati aggiunti alcuni cristalli di muresside, indicatore che forma complessi solo con Ca2+ (conferendo alla soluzione un colore rosa pallido), e altra acqua distillata portando la soluzione al volume di 50ml. Aggiungendo il titolante EDTA goccia a goccia, quando è stata raggiunta l'equivalenza, cioè quando metà degli equivalenti di EDTA hanno reagito con metà degli equivalenti della nostra soluzione, il colore ha virato da rosa pallido a violetto, ai seguenti volumi:
V1 = 6,1ml, V2 = 5,7ml, V3 = 6ml, con Vm = (V1+V2+V3)/3 = 5,93ml, da cui abbiamo calcolato la [Ca2+].
MCa2+ = (MEDTA *VEDTA)/VCa2+=(0,01*5,93)/25 = 2,372*10-3 mM
Per differenza è stato possibile calcolare anche la concentrazione di Mg2+:
([Mg2+]+[ Ca2+]) - [Ca2+] = 3,38*10-3 mM - 2,372*10-3 mM = 1,008*10-3 mM
Se la concentrazione di Mg2+ fosse stata maggiore di quella del Ca2+, avrebbe significato che l'acqua da noi analizzata sarebbe stata stagnante, cioè a contatto con dei vegetali in decomposizione, dato che il magnesio in essa contenuto deriva proprio dalla clorofilla delle piante.





|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2025