|
|
| |
Avvertenza
Questa raccolta di appunti di SISTEMI ENERGETICI del prof. A. Mittica è stata scritta da uno studente ignoto durante l'anno accademico 92/93.
I professori del corso giurano che ci siano alcuni errori. Quindi non prendete mai per oro colato quello che trovate di seguito.
Quest'anno (1994/95) ho deciso di provare a reimpaginare il documento (inizialmente 180 pagine -praticamente impossibile da stampare a casa) in modo che occupasse un numero ragionevole di pagine e fosse anche di più facile trasporto-consultazione e non ultimo evitasse un inutile spreco di carta.
Ho anche aggiunto all'inizio di ogni capitolo usa sorta di sommario\riepilogo che trovo molto utile in fase di studio e di ripasso. Consiglio di leggere sempre questa parte prima di cominciare a studiare in modo da crearsi delle aspettative. Ponetevi spesso domande in merito a ciò che sapete già riguardo ad un certo argomento e a che cosa vi fa venire in mente. Finito il tempo che intendete dedicare allo studio di un certo argomento (e preferibilmente ogni ora) fermatevi per 5 minuti, fate qualcosa che vi distragga e poi ripassate quello che avete appena studiato, aiutandovi con le parole chiave scritte nella sezione iniziale. Ovviamente, trattandosi non di una parte ufficiale degli appunti, ma più che altro di una parte di utilità, conterrà molte abbreviazioni (e anche qualche errore).
Il documento è a disposizione di tutti, siete invitati a divulgarlo sia sotto forma cartacea che magnetica. Siete però pregati di non modificarlo e di lasciare insieme tutti gli 11 capitoli e i files collaterali.
Introduzione
Un sistema energetico è un insieme di uno o più organi atti ad elaborare l'energia ricevuta sottodiverse forme per convertirla in forme direttamente o comodamente utilizzabili.
Esso può essere identificato con un singolo oggetto (ad esempio uno uno scambiatore di calore, il cui scopo è trasferire energia termica da un fluido ad un altro) o in più organi che costituiscano un sistema complesso, ad esempio un impianto vapore per la produzione di energia elettrica.
Sistemi motori primi: convertono energia prelevata da sorgenti naturali, in quantità sempre minori a causa delle inevitabili perdite, nel tipo e nella forma più adatti all'impiego da parte dell'uomo.
Oltre ai sistemi motori primi si parla anche di sistemi nei quali si fornisce energia termica (a bassa temperatura) e lavoro meccanico, che viene anch'essa trasformata in energia termica, col beneficio però di nobiltare il calore assorbito portandolo a temperature più alte.
Questi ultimi sistemi vengono impiegati essenzialmente per:
a) sottrarre calore da un ambiente più freddo (impiantifrigoriferi);
b) cessione di calore ad un ambiente caldo (pompe di calore);
c) introduzione di lavoro meccanico nel fluido (ciclo dicompressione).
Al processo fondamentale di conversione (per i motori primi: energia primaria energia meccanica) sovraintende un insieme di apparecchi tra loro interconnessi in relazione all'esigenza di realizzare in ciascuno di essi una delle fasi del processo.
Esempi classici sono:
motore automobile: converte energia chimica (contenuta nel combustibile) in energiameccanica;
impianto a vapore di una centrale elettrica:
- generatore di vapore;
- condensatore;
- turbine motrici;
- pompe.
I principali processi di conversione d'energia sfruttano l'evoluzione dei fluidi per operare la conversione stessa: segue che le macchine di maggiore interesse hanno il compito di realizzare e guidare nella maniera più conveniente la suddetta evoluzione dei fluidi.
Capitolo 1
Fondamenti di termodinamica ed energetica applicata
Definizioni:
Sistema
Chiuso: Scambia energia e Q. moto ma non materia
Aperto
Proprietà: qualità misurabili di un sys (pari condizioni => pari proprietà )
Intensive
Estensive
Stati: Insieme di proprietà TD che caratterizzano il sys
P, v massico, T
Equilibrio
Moto:
periodico
stazionario
Trasformazioni:
Reversibili
Irreversibili
Variazioni di stato: (ma non funzioni di stato)
Lavoro Energia causata da forza che genera spostamento al confine del sys
Calore Energia che si ha al confine del sys quando varia T
Criteri di Studio di un sys TD:
Lagrangiano Evoluzione di una massa
Euleriano Evoluzione si un sys entro un volume di controllo
PTD1 (conservazione NRG - no dim del contrario )
Forma LAGRANGIANA (dQe+dL=dE <=> dQe+dLw=dU+pdV)
sviluppo dE = dEc + dU + dEg + dEw + ...
integro + ipotesi semplificativa
Forze passive => dL = dLw+dEc -pdv (Lw= lav. forze passive)
Ricavo espressione finale
Forma EULERIANA (dQe + dLi = Di + DEc + DEg)
volume di controllo, sys aperto, moto unidimensionale e stazionario
Potenza termica e meccanica
Lavoro di spostamento
NRG cinetica
Entalpia
Portata in massa (m punto)
Unione delle due forme : ![]()
DEg trascurabile per i gas
TEOREMA di Bernoulli
(genralizzato e classico) ![]()
Ciclo TD:
trasformazioni; finale=iniziale; fittizie (completamento)
macchine operatorici; motrici
ciclo diretto
Integro PTD1 => dQ-dL è funz. di stato. L=Q1-Q2
Diagramma di Clapeyron (p,v)
PTD2: (possiblità o meno che avvenga una certa trasformazione)
Analogia col bacino idrico
Ciclo di carnot (2 adiabatiche, 2 isoterme)
Studio dei 3 postulati di Carnot
1. rendim è funzione solo della T1 e T2
2. valore del rendim. di un ciclo REV
scompongo con cicli di Carnot
definisco ENTROPIA (f. di stato)
3. rend ciclo IRR < rend ciclo REV
Risultato: TdS=dQe+ dLw= dU + pdV= di - vdp
Sistema (o sistema chiuso): è un insieme di materia ben definito. Esso è suscettibile di variazioni di quantità di moto, energia, ma non di massa. Noi considereremo sistemi che trattano di fluidi.
Esterno : è tutto ciò che non fa parte del sistema.
Proprietà: è una quantità osservabile di un sistema. Il valore che assume quando il sistema è in determinate condizioni è sempre lo stesso indipendentemente dal modo con cui queste condizioni vengono raggiunte.
Proprietà intensive: sono proprietà che non dipendono dalla massa del sistema (ad es. p,T,c velocità). Le proprietà determinano lo stato di un sistema.
Proprietà estensive: Tutte quelle che dipendono dalla massa (o dall'estensione del sistema)
Per stato di un sistema si intende l'insieme delle proprietà che servono ad identificarlo. Queste proprietà devono essere delle caratteristiche rilevanti da un punto di vista termodinamico.
Lo stato esterno di un sistema è individuato dalle tre componenti della velocità come funzioni del tempo e dello spazio occupato dal sistema.
Lo stato interno di un sistema, chimicamente definito, è individuato, se il sistema è omogeneo, da due parametri usualmente scelti fra:
- pressione p
- temperatura T grandezze fenomenologiche (cadono sotto i nostri sensi)
- volume massico v
Per pressione su una determinata superficie reale o ideale intendiamo il rapporto tra la forza normale che agisce su quella superficie e l'area:
[p]= N/m2 = Pa nel S.I.
La temperatura si misura in:
[T]= K oppure [T] = °C
Il volume massico è il rapporto tra il volume occupato da una determinata massa e il valore della massa:
[v] = m3/Kg nel S.I.
Il volume che noi consideriamo è sempre molto grande rispetto al volume dei singoli atomi.
Consideriamo la termodinamica macroscopica dei sistemi con masse molto maggiori rispetto a quelle atomiche o molecolari. E' la termodinamica che si presta ad essere trattata in modo notevolmente semplificato in quanto riduce il numero delle variabili che bisogna prendere in considerazione per identificare lo stato del sistema.
Un sistema si trova in uno stato di equilibrio se mantiene inalterato il suo stato quando lo si isola rispetto all'esterno in modo da impedire lo scambio di calore e lavoro.
Diremo che una trasformazione tra uno stato iniziale di equilibrio e uno stato finale di equilibrio è reversibile quando tutti gli stati intermedi sono di equilibrio. A rigore solo queste trasformazioni possono essere rappresentate graficamente; le trasformazioni non reversibili passano attraverso stati che non sono di equilibrio e pertanto non possono essere rappresentate graficamente.
Lo studio di un sistema fluido viene affrontato con il criterio lagrangiano (o sostanziale) che consiste nel seguire il sistema nelle sue evoluzioni, come si segue un corpo nella dinamica del corpo rigido.
Il criterio di studio euleriano consiste nel seguire le evoluzioni delle proprietà del fluido in una regione dello spazio occupata dal fluido stesso, senza riferimento al fatto che il fluido si rinnova continuamente. La superficie che delimita tale regione è detta superficie di controllo. Questo criterio di studio risulta particolarmente comodo (in un sistema aperto) quando il fluido che si evolve è in moto puramente periodico.
Una corrente fluida è in moto permanente (o stazionario) quando le proprietà del fluido in ogni punto della corrente non dipendono dal tempo.
Un fluido è in moto periodico (o ciclico) quando in un punto si ritrovano le stesse proprietà dopo un intervallo di tempo pari al periodo.
Il lavoro è l'energia che compare al confine del sistema considerato quando questo cambia stato in seguito allo spostamento del confine sotto l'azione di una forza. Affinchè esista lavoro deve esistere sia la forza sia lo spostamento.
Il calore è l'energia che si manifesta al confine del sistema quando questo cambia il suo stato a causa di una differenza di temperatura tra una zona del confine e l'esterno.
Calore e lavoro non sono funzioni dello stato, ma sono funzioni della trasformazione che si segue per passare da uno stato all'altro.
Conseguentemente non ha senso parlare di differenziale matematico quando si parla di calore e lavoro.
Per il calcolo del lavoro tra lo stato 1 (iniziale) e 2 (finale) non posso considerare solo lo stato iniziale e finale ma devo considerare tuttti gli stati intermedi della trasformazione. Analogamente per il calore:
![]()
La sua forza sta essenzialmente nel fatto che non si è riusciti a provare che non vale, oltre a confermare la nostra intuizione fisica.
La conservazione dell'energia di un sistema in una trasformazione elementare è espressa da una relazione del tipo:
dQe+ dL = dE (1.1)
dove:
dQe è il calore netto che il sistema riceve dall'esterno (conduzione e irraggiamento);
dL è il lavoro compiuto dalle forze trasmesse al sistema per contatto superficiale con l'esterno;
dE è la variazione di energia del sistema conseguente al calore dQ ed al lavoro dL ricevuto;
(nota: dQe dL sono infinitesimi e non differenziali)
L'energia E del sistema è la somma dell'energia interna U, dell'energia cinetica su scala macroscopica Ec, dell'energia potenziale Eg dovuta al campo gravitazionale, Ew dovuta ad un campo di forze centrifughe (dipendente dal sistema di riferimento adottato) ed inoltre Ee ed Em dovuti ad eventuali campi elettrici e magnetici nel caso in cui il sistema sia ionizzato. Per i casi che interessano le applicazioni ai sistemi energetici Ee ed Em mancano.
![]()
Dove m è la massa del sistema, è l'energia interna per unità di massa, associata al comportamento molecolare e atomico del sistema e si può intendere, su scala macroscopica, come l'energia che il sistema possiede per il fatto di esistere in un certo stato interno e con una data composizione chimica:
![]()
dove c è la velocità dell'elemento dm del sistema valutato in un sistema di riferimento non inerziale.
![]()
dove z è la quota dell'elemento dm lungo un asse verticale orientato verso l'alto a partire da una quota di riferimento arbitraria; e g è l'accelerazione di gravità alla quota z.
![]()
dove r è la distanza dell'elemento dm dall'asse di rotazione in un sistema di riferimento rotante con la velocità angolare attorno ad un asse fisso.
Integrata tra gli estremi di una trasformazione finita la (1.1) si scrive:
Qe + L =U +Ec + Eg + Ew
Se il sistema è un fluido comprimibile (gas,vapore) le variazioni diEg sono in genere trascurabili rispetto a U ( Eg <<U), e per un sistema di riferimento inerziale (Ew = 0) si ottiene:
Qe+ L =U + Ec
Per un sistema omogeneo il principio di conservazione dell'energia, con riferimento all'unità di massa, è:
dQe + dL = dE (1.1')
e con le ipotesi semplificative precedenti:
dQe +dL = dU + dEc (1.2)
Durante la trasformazione di un sistema fluido si hanno, in genere, dissipazioni d'energia meccanica provocate dall'attrito in seno al fluido e tra fluido e pareti, dette perdite per resistenze passive.
Nelle espressioni scritte del I principio tali perdite, che chiameremo anche lavoro delle resistenze passive e indicheremo con dLw, non comparivano esplicitamente.
Si può dimostrare che per una trasformazione qualunque il bilancio di energia meccanica massica del sistema elementare è ora espresso dalla:
dL = -p dv + dEc + dLw
e sostituito nella (1.2) il I principio della termodinamica assume la forma:
dQe + dLw = dU + p dv
indicato anche con:
dQ = dQe + dLw = dU + p dv
per una trasformazione reversibile :
dQ = dQe = dU + p dv
Il problema si sposta dallo studio di una massa definita allo studio di una regione detta volume di controllo.
Il volume di controllo è un volume arbitrario attraverso i confini del quale si possono avere trasferimenti di massa, quantità di moto, energia. Esso delimita un sistema aperto la cui massa non è necessariamente costante. Se il moto è stazionario la massa di un sistema aperto è costante.
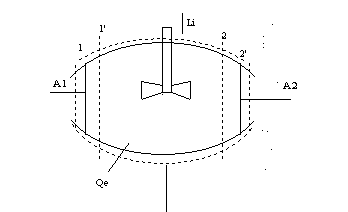
Figura 1. 1 rappresentazione schematica di una turbomacchina
m: massa compresa tra 1 e 2 ad un dato istante t in dt
1 1'
2 2'
le nuove sezioni comprendono sempre la stessa massa m in t + dt
Il flusso della corrente è unidimensionale (è necessaria una sola coordinata spaziale, ad es. l'ascissa di una sezione lungo la direzione della corrente, per localizzare la proprietà) oltre che stazionario.
Definiamo:
Qe=![]() : potenza termica fornita al sistema aperto
attraverso le pareti del volume di controllo non attraversate dal fluido.
: potenza termica fornita al sistema aperto
attraverso le pareti del volume di controllo non attraversate dal fluido.
Li=![]() : potenza meccanica (Pi) fornita al sistema aperto, ad es.
dalle pale di un albero rotante, che attraversa la superficie di controllo.
: potenza meccanica (Pi) fornita al sistema aperto, ad es.
dalle pale di un albero rotante, che attraversa la superficie di controllo.
dmf : massa che in dt fluisce attraverso la sezione 2 e si viene a trovare compresa tra le sezioni 2 e 2'; tale massa, per le condizioni del moto considerato, è anche la massa che attraversa nel tempo dt la sezione 1 ed è compresa fra le sezioni 1 e 1'.
Applichiamo il I principio della termodinamica alla trasformazione subita dalla massa m nell'intervallo di tempo dt.
La conservazione dell'energia della massa m è espressa da:
dQe + dL = dU + dEc + dEg = dE
il calore fornito dall'esterno :
dQe = Qedt
il lavoro fornito dall'esterno:
dL = Lidt + p1A1![]() - p2A2
- p2A2![]() = Lidt + p1v1dmf -
p2v2dmf =
= Lidt + p1v1dmf -
p2v2dmf =
= Lidt + ![]()
La variazione di energia cinetica dEc è data dalla differenza fra l'energia cinetica della
massa m all'istante t + dt e quella all'istante t. Essendo, per la
stazionarietà del moto, l'energia cinetica della massa m - dmf
compresa fra le sezioni 1'e 2 uguale agli istanti t e t + dt si ha: ![]()
analogamente per le variazioni di energia interna e di energia potenziale:
dU = (U2 - U1)dmf
dEg = g(z2 - z1)dmf
si ha pertanto:
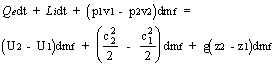
ed introducendo la funzione di stato entalpia : i = U + pv
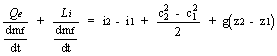
dove![]() è la massa che fluisce attraverso la sezione 1, la sezione 2
e attraverso qualunque sezione della macchina.
è la massa che fluisce attraverso la sezione 1, la sezione 2
e attraverso qualunque sezione della macchina.
Si ha quindi:
![]() = Qe
= Qe
calore fornito dall'esterno per unità di massa che attraversa la superficie di controllo;
![]() = Li
= Li
lavoro fornito dagli organi mobili della macchina al fluido per unità di massa che l'attraversa.
Il I principio scritto in forma euleriana per condizioni di moto stazionario, con riferimento all'energia massica della corrente diventa:
Qe + Li = i + Ec +Eg (1.3)
con si intende la variazione fra la sezione di uscita e quella di ingresso del fluido nel volume di controllo.
Tutti i termini che compaiono nella (1.3) si riferiscono a misure fatte al contorno del volume di controllo. Pertanto essa è applicabile anche ad un sistema aperto in condizioni di moto periodico se tutti gli eventi al contorno non dipendono dal tempo.
- forma lagrangiana forma euleriana
Qe mQe in
- per dt 0 il volume di controllo è praticamente fisso nello spazio, altrimenti ci sarebbe stata contraddizione tra il metodo seguito da noi per lo studiuo del sistema e le ipotesi del criterio euleriano di studio.
- Osserviamo la figura 1.2:

Figura 1. 2
la massa dmf in x scambia con gli strati contigui delle energie che, a due a due, sono uguali in modulo e con segno opposto nella successione temporale occupate da dmf. Pertanto nell'intervallo t di passaggio dal volume 1 1'al volume 2 2'riceve proprio l'energia Qe + Li.
Se fotografassimo la situazione spaziale all'istante t vedremmo la configurazione assunta da dmf quando si trova ad occupare una situazione intermedia tra 1 e 2.
Dal I principio scritto in forma lagrangiana:
dQe + dLw = dU + p dv = di - vdp
che integrata fra gli stati del fluido nelle sezioni 1 2 dà:
![]()
ed uguagliata con l'espressione determinata per il criterio euleriano:
Qe + Li = i + Ec + Eg
si ottiene:
![]()
il lavoro massico fatto dal fluido sugli organi mobili della macchina ha un'espressione uguale, ma di segno contrario, alla (1.4).
- fluido comprimibile
Eg trascurabile rispetto a i
i = 1 Kcal/Kg = 9,8 * 427 J/Kg ;
la stessa variazione di Eg implicherebbe:
9,8 m/s2 * 427 m = g z z = 427m
Qe + Li = i + Ec
![]()
- fluido incomprimibile
Nelle macchine idrauliche i fenomeni termici sono poco significativi. Si utilizza la:
Li = ![]() +Ec + g z + Lw
+Ec + g z + Lw
essendo il volume massico v, e quindi la densità ( = 1/v), costante.
Nei liquidi reali il volume massico varia, ma le sue variazioni di solito possono essere trascurate. La relazione:
Li = ![]() + Ec + g z + Lw
+ Ec + g z + Lw
esprime il teorema di Bernouilli generalizzato. Infatti per un condotto fisso (Li = 0) e in assenza di resistenze passive (Lw = 0) si ottiene:
![]() + Ec + g z = 0
+ Ec + g z = 0
che esprime il teorema di Bernouilli nella forma classica:
![]()
Un ciclo termodinamico è una sequenza di trasformazioni (con scambio di lavoro e calore con l'esterno) che riportano una data massa di fluido al suo stato iniziale.
Si parla talvolta di "ciclo termodinamico" anche nel caso di processi aperti, soprattutto allo scopo di unificare certe trattazioni analitiche (in genere questo richiede paradossali ipotesi per potere accettare questa semplificazione, tipo trasformazioni di chiusura capace di riportare il fluido scaricato nelle condizioni chimiche e fisiche).
Consideriamo il diagramma cartesiano di Clapeyron. Sugli assi sono riportati, in ordinate, la pressione p e in ascisse il volume massico v. Rappresentiamo un ciclo termodinamico qualsiasi ma reversibile:

Figura 1. 3 Diagramma di Clapeyron
Dove con abbiamo indicato m,n n° di trasformazioni da A a B e viceversa.
Applichiamo il I principio della termodinamica con riferimento al lavoro netto L ottenuto:
dQe - dL = dE applicato al ciclo
Qe - L = 0 stato iniziale = stato finale nel ciclo chiuso
mentre con riferimento all'unità di massa che percorre il ciclo:
Qe - L = 0
dove: L = Q1 - Q2
con Q1 = calore fornito nel ciclo; e Q2 = calore sottratto nel ciclo.
Nella forma integrale:

e quindi:
![]()
trattandosi di trasformazioni reversibili posso scrivere:
![]()
e quindi:
![]()
con m e n qualunque.
La reversibilità di una trasformazione implica che la trasformazione percorsa in un senso possa essere percorsa in senso inverso scambiando con l'esterno la stessa quantità di energia (si tratta quindi di una trasformazione molto lenta in modo che per ogni stato intermedio si possa raggiungere l'equilibrio in ogni molecola del fluido).
Da quanto sopra dimostrato, qualunque trasformazione che da A porta a B dà lo stesso contributo nel termine:
![]()
nonostante la possibile variazione di dQe e dL nelle varie trasformazioni.
Il primo principio della termodinamica stabilisce che l'energia si conserva. Esso non pone alcuna limitazione alla possibilità di convertire calore in lavoro e lavoro in calore, imponendo soltanto che l'energia venga conservata nel processo.
Il secondo pone un limite alla possibilità di trasformazione di calore in lavoro e afferma che sono necessarie due sorgenti affinchè si abbia scambio.
Consideriamo il problema del rendimento di un ciclo termodinamico. Si chiama rendimento di un ciclo termodinamico diretto, cioè avente lo scopo di produrre lavoro meccanico, il rapporto tra il lavoro ottenuto e la quantità di calore corrispondentemente fornito al fluido che percorre il ciclo:
![]()
dal I principio: L = Q1 - Q2
con Q1 = fornito dal sistema all'esterno; Q2 = fornito al sistema dall'esterno.
Consideriamo una macchina idraulica la quale sia alimentata da un serbatoio e scarichi in un altro serbatoio:

Figura 1. 4 rappresentazione schematica di una macchina idraulica
Il lavoro massimo è ottenibile dalla macchina, assegnati z1 e z2, quando ricorrono le seguenti condizioni :
- l'acqua è raccolta tutta allivello più alto;
- l'acqua è scaricata tutta al livello più basso;
- nella tubazione non ci sono perdite d'acqua e non ci sonoattriti.
In base a questo esempio Carnot ha stabilito un legame con la termodinamica.
Il lavoro massimo ottenibile da un sistema, assegnati i livelli di temperatura T1 e T2, si ottiene fornendo dall'esterno calore al sistema tutto alla temperatura minima T2, con trasformazioni intermedie adiabatiche e senza attrito.
La trasformazione adiabatica garantisce la mancanza di scambio di calore nelle trasformazioni intermedie (parallelo con l'assenza di perdite d'acqua nelle condutture).
Il ciclo di Carnot rappresentato nel diagramma cartesiano p,v risulta:

Figura 1. 5 ciclo di Carnot
AB,CD trasf. isoterme BC,DA trasformazioni adiabatiche reversibili
N.B: la rappresentazione delle trasformazioni termodinamiche isoterme e isoentropiche va inizialmente accettato.
1) Il rendimento del ciclo di Carnot è funzione soltanto delle temperature T1 e T2.
c = f(T1,T2) non dipende dal sistema che sta effettuando il ciclo
2) Il rendimento di un ciclo di Carnot reversibile ha la forma:
c,rev = 1- ![]()
da questo segue:
![]()
infatti:
![]()
quest'ultima relazione è valida per qualunque ciclo, ed assume una forma molto semplice nel caso del ciclo di Carnot.
3) Il rendimento del ciclo di Carnot reversibile è maggiore di quello del ciclo di Carnot irreversibile:
c,rev >c,irrev
Consideriamo un ciclo reversibile generico:

Figura 1. 6
Approssimo con tanti cicli di Carnot infinitesimi il ciclo considerato.
Considero ora uno dei cicli di Carnot infinitesimi (le due adiabatiche sono infinitamente vicine in modo da approssimare con i tratti di isoterma i tratti del ciclo staccati dalle adiabatiche).
Introduco la quantità di calore infinitesima dQ1 e sottraggo dQ2. Grazie all'ipotesi di reversibiltà nel percorrere un ramo adiabatico in un senso e poi nell'altro non modifico il ciclo. Per il ciclo infinitesimo di Carnot posso scrivere:
![]()
e quindi:
![]()
Posso scrivere tante relazioni di questo tipo per tutti i cicli infinitesimi di Carnot che costituiscono il ciclo reversibile; si ottiene il risultato:
![]()
Con rifrimento agli stati A e B:
![]()
e poichè si tratta di un ciclo reversibile:
![]()
abbiamo individuato un altro differenziale esatto (valore funzione solo degli estremi):
![]()
S = entropia - funzione di stato - [S] = J/K
L'entropia si può considerare come un indice del disordine molecolare del sistema.
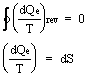
relazioni valide per cicli reversibili
Consideriamo ora il terzo postulato di Carnot: c,rev > c,irrev
Sia dato il generico ciclo irreversibile:

Figura 1. 7 generico ciclo
![]()
che corrisponde alla condizione:
![]()
Il punto di partenza della dimostrazione è la disuguaglianza
![]()
Effettuo gli stessi passaggi logici del caso del ciclo reversibile (approssimo cioè il ciclo con tanti cicli di Carnot infinitesimi)
![]()
![]()
considero quindi tutti i cicli infinitesimi
![]()
divido il ciclo in due parti, la parte reversibile (n) e la parte irreversibile (m) e sfrutto il fatto che la trasformazione n sia reversibile:
![]()
![]()
questa è una trasformazione reversibile per cui dQ/T = dS:
![]()
soluzioni valide per ciclo irreversibile
La spiegazione della disuguaglianza sta nella irreversibilità, e cioè nell'attrito interno dei fluidi ( è la principale causa di irreversibilità che si considera nello studio delle macchine).
Altre cause possono essere i fenomeni di mescolamento.
Scriviamo la relazione in questo modo:
TdS = dQe + dQw
dQe tiene conto del calore scambiato con l'esterno
dQw: valore introdotto dal sistema dall'interno a causa dell'attrito interno dei fluidi (è sempre una quantità positiva, ricevuta dal sistema).
Il II° principio della termodinamica definisce l'entropia S come una funzione di stato il cui differenziale è dQ/T in una trasformazione qualsiasi, reversibile o irreversibile
![]()
dQ = dQe+dQw
><0 >0
con riferimento ai casi in cui il calore di irreversibilità è conseguente al lavoro delle resistenze passive (dQw=dLw) si ha:
TdS = dQe + dLw
da questa relazione risulta come una trasformazione reale si può rendere (almeno in sede teorica) isoentropica (dS=0) sottraendo al sistema il calore massico dQe = dLw
Dal I° principio:
dQe + dLw = dU + pdv
TdS = dU + pdv = di - vdp
Osserviamo infine che l'entropia, come tutte le funzioni di stato, è definita univocamente per ogni stato del sistema indipendentemente dalla trasformazione.
Pertanto:
![]()
qualunque sia la trasformazione reale da A a B.
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2024