|
|
| |
Corso di laurea in Biotecnologie
Esame di Laboratorio di Chimica Biorganica
Scopo di quest'esercitazione è l'idrolisi di un disaccaride, il lattosio, la purificazione e l'acetilazione dei due monosaccaridi risultanti dall'idrolisi e la loro analisi alla gas - massa.
Si sono sciolti in un pallone a smeriglio da 50 ml 25mg di lattosio in 1 ml di acido trifluoroacetico (TFA) 2 N. Il pallone, tappato, è stato lasciato sotto agitazione per un'ora in un bagno d'olio a circa 120°C.

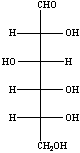
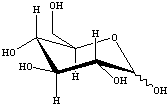
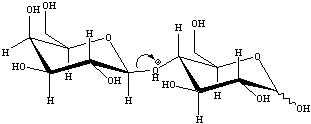
![]() Il TFA catalizza l'idrolisi del legame b - 1,4 glicosidico tra il galattosio e il glucosio,
portano alla formazione dei due m 232i83c onosaccaridi liberi. Ciascun monosaccaride si
trova ora sia nella forma aperta che come miscela degli anomeri a e b.
Il TFA catalizza l'idrolisi del legame b - 1,4 glicosidico tra il galattosio e il glucosio,
portano alla formazione dei due m 232i83c onosaccaridi liberi. Ciascun monosaccaride si
trova ora sia nella forma aperta che come miscela degli anomeri a e b.
![]()
![]()
Miscela degli anomeri a e b
|
Miscela degli anomeri a e b |
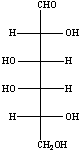
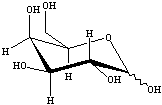

![]()
![]()
Una volta raffreddato il pallone sono stati aggiunti alla soluzione 5 ml di isopropanolo e si è portato a secco. L'operazione è stata ripetuta per tre volte.
La soluzione viene così pulita dal TFA e dall'isopropanolo, lasciando nel pallone solo i monosaccaridi. L'isopropanolo reagisce con il TFA formando un estere bassobollente, facilmente eliminabile portando a secco la soluzione. L'operazione è necessaria perché il TFA ha un punto di ebollizione troppo alto perché venga eliminato al rotovapor.
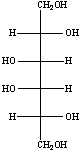
Successivamente si sono aggiunti al campione 15 mg di NaBH4.
Il NaBH4 è necessario per ridurre il carbonio aldeidici dei monosaccaridi. Poiché l'aldeide viene continuamente sottratta all'equilibrio con le forme cicliche a e b, alla fine tutte le molecole di galattosio e glucosio sono ridotte a galattositolo e glucitolo.
La soluzione è stata lasciata riposare per un tempo sufficientemente lungo, dopodiché sono state aggiunte alcune gocce di acido acetico.
L'operazione è stata dettata dalla necessità di eliminare gli ioni H- in eccesso, provenienti da NaBH4. La formazione di idrogeno gassoso dalla combinazione di H+ e H- è la causa dell'effervescenza osservata.
A questo punto sono stati aggiunti 10 ml di una soluzione acido acetico : metanolo (1:9) e si è portato a secco. Il procedimento è stato ripetuto per quattro volte.
In questo modo il sodio e il boro presenti nel pallone formano NaOCOCH3 e B(OCOCH3)3.
Al campione sono stati poi aggiunti 10 ml di solo metanolo e si è di nuovo portato a secco. L'operazione è stata ripetuta per tre volte, facendo attenzione che l'ultima volta il campione fosse ben secco.
Il metanolo converte l'estere borico, poco volatile, in B(OCH3)3, più volatile e facilmente eliminabile per distillazione.
Alla soluzione sono stati poi aggiunti 1 ml di anidride acetica e 1 ml di piridina anidra. Il pallone è stato lasciato sotto agitazione per 20 minuti a 120°C, ben tappato con parafilm.

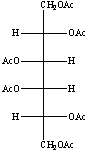
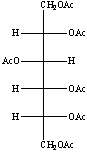
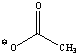
Dopo aver raffreddato il pallone sono stati aggiunti 2 ml di toluene e 1 ml di metanolo.
Il toluene forma con la piridina un azeotropo, mentre il metanolo forma con l'acido acetico acetato di metile. Questi prodotti sono facilmente eliminabili per distillazione.
Si è poi portato a secco, in modo da lasciare nel pallone solo gli alditoli acetati e NaOAc.
In seguito il campione è stato disciolto in 5 ml di cloroformio ed è stato posto in un imbuto separatore insieme a 5 ml di acqua distillata. Dopo aver dibattuto la soluzione sono state separate la fase organica dalla fase acquosa. L'operazione è stata ripetuta più volte.
In questo modo si allontana la fase acquosa, contenente il sale, da quella organica, contenente gli alditoli acetati.
In seguito alla soluzione è stato aggiunto del solfato di sodio e si è portato a secco.
Il solfato di sodio serve per eliminare le tracce di acqua ancora presenti nella soluzione.
Il campione così ottenuto è stato analizzato alla gas - massa. I tempi di ritenzione per i due composti sono risultati differenti, come c'era da attendersi, e in corrispondenza dei valori attesi.
Anche lo schema di frammentazione degli ioni molecolari ha indicato che il campione realmente conteneva i due alditoli acetati.
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2024