|
|
| |
Titolazione conduttometrica
Obiettivo: Eseguire la titolazione di acido cloridrico con soda caustica mediante prova di conducibilità
della soluzione.
Tracciare in seguito il grafico conducibilità/volume di titolante.
La conducibilità (simbolo λ) in campo sia chimico che elettrico è la capacità di un qualsiasi corpo 949e48j
(sia esso in fase liquida o solida) a lasciar trapassare corrente elettrica.
Esso si definisce conduttore e maggiore è la sua conducibilità maggiore sarà più facilmente attraversato dal passaggio forzato e continuo di elettroni (o di ioni se si parla di liquidi e soluzioni).
Matematicamente è l'inverso della resistenza: cioè non misura l'opposizione delle molecole al passaggio di elettricità bensì la loro attitudine a farsi attraversare dal flusso: λ=1/ R.
Strumenti: conducimetro digitale.
Materiale: beker (portata: 80 mL; sensibilità: 20 mL)
beker (portata: 250 mL; sensibilità: 50 mL).
Sostanze: HCl (x M; R23-25; S1-2-9-26-36/37/39-45)- Matraccio n°1
NaOH (sol. acq. 0,1M; C; R35; S26-37-39-45)
H2O (distillata).
D.P.I: camice.
Rappresentazione grafica esperienza:
Sequenza operativa:
Prendere il matraccio con la soluzione ignota di HCl e contrassegnare il numero dello stesso
Versare 20 mL di detta soluzione in 200-250 mL di H2O distillata dentro un baker (non importa il volume preciso perché non influisce sulla massa di HCl della soluzione di partenza)
Affinare la buretta con acqua distillata e riempirla con 25 mL di NaOH
Prendere l'ancoretta e metterla dentro il beker e appoggiare il beker sopra il supporto magnetico che fa girare l'ancoretta (al fine di agitare omogeneamente la soluzione)
Prendere l'elettrodo del conducimetro e appoggiarlo dentro il baker e rilevare il primo dato di conducibilità ionica della soluzione senza ancora aver aggiunto il titolante
Ad intervalli regolari di 1 mL di NaOH aggiunto alla soluzione all'interno del beker prendere il valore letto sul display elettronico del conducimetro. I valori man mano diminuiranno fino a che si arriva al punto in cui la soluzione è neutra (pH=7) e quindi non conduce elettricità
Dopo questo punto di equilibrio (deducibile e ricavabile dal grafico) la conducibilità aumenterà perché la soluzione essendo più basica conduce elettricità
Calcolare e titolare l'acido cloridrico attraverso l'elaborazione dei dati disponibili dal volume e dalle concentrazioni note.
Reazione:
HCl → H+ + Cl-
HCl + NaOH → Na+ + Cl- + H2O
Nella soluzione ignota di acido cloridrico vi è una dissociazione ionica dell'acido, che produce ioni H+ e Cl'.
L'acido, essendo forte, si dissocia quasi totalmente.
sarà quindi difficile che si riformi il reagente con i prodotti ormai sciolti in soluzione.
In compenso la soluzione sarà:
per il primo tratto discendente del grafico acida
nel secondo tratto ascendente basica .
Elaborazione dati:
V(HCl)= 20 mL=
Vmed NaOH)= 7,2 mL=
n (HCl)= n (NaOH)
x[HCl * V(HCl)= [NaOH] * Vmed(NaOH)
x[HCl = ([NaOH] * Vmed(NaOH)) / V(HCl)= 0,036 mol/L
n (HCl)= [HCl]* V (HCl)= 0,00072 mol
MM (HCl Ar(H)+ Ar(Cl) = 36,5 g/mol
M (HCl)= n (HCl)* MM
(HCl)= 0,00072 mol * 36,5 g/mol=
Grafico:
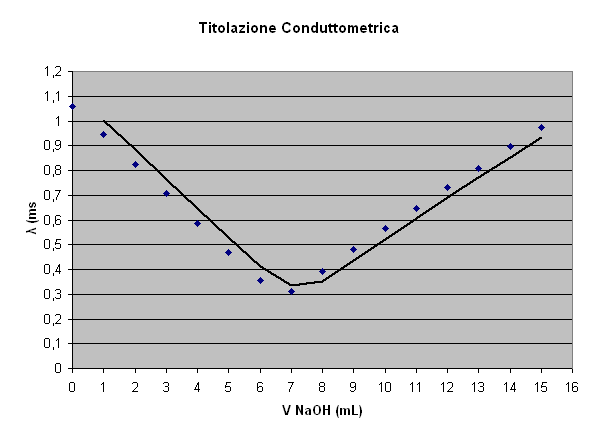
Conclusioni: In questa esperienza abbiamo titolato dell'acido cloridrico mediante un processo noto come titolazione conduttometrica, basato sul fatto che a pH neutro non vi sia conducibilità della soluzione. Abbiamo eseguito le varie prove e abbiamo infine calcolato sia la concentrazione dell'acido cloridrico che la massa presente nel volume iniziale (20 mL) di titolato.
Ci è pervenuta una concentrazione pari a 0,036 mol/L, che( al limite degli errori sperimentali ) può risultare concordante con il dato conosciuto (presumibilmente quella vera è 0,04 mol/L).
Il volume di NaOH è stato ricavato dall'intersezione delle due rette di tendenza dei valori a sinistra e a destra del valore medio (che è stato pari a 7,2 mL).
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2024