|
|
| |
Ricezione e risposta ai segnali biologici
Negli organismi pluricellulari lo scambio di informazioni tra cellule è di fondamentale importanza per il normale funzionamento degli apparati. I numerosi segnali vengono identificati da appositi recettori situati sulla membrana cellulare il quale converte il segnale in una risposta (trasduzione).
I segnali a cui devono rispondere le "cellule bersaglio", sono moltissimi e tutti estremamente importanti sia per la difesa che per regolare i normali processi fisiologici. Ad esempio le cellule devono riconoscere e rispondere agli antigeni, ai segnali di sviluppo, ai fattori di crescita, agli ormoni, alla luce, alle stimolazioni meccaniche, ai neurotrasmettitori, agli odori, ai sapori... ect.
Nonostante l'elevata e differenziata varietà di segnali, le risposte che l'evoluzione ha conservato, sono realizzate mediante meccanismi relativamente poco numerosi.
Meccanismi molecolari di trasduzione del segnale
I recettori sono proteine di membrana altamente specifici che
legano selettivamente, in un sito esterno, le molecole del segnale media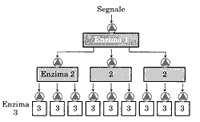 nte interazioni chimici deboli. La capacità
dei recettori di identificare e di legarsi alle
molecole del segnale è talmente elevata che queste interazioni possono avvenire
anche quando la concentrazione del ligando [segnale] è molto piccola. Una volta
legati, il complesso recettore-molecola del segnale innesca un meccanismo di 545c23f amplificazione dovuta all'azione
di un enzima legato al recettore che provoca una cascata
enzimatica, attivando molte molecole di un secondo enzima
e poi di un terzo e così via. [vedi figura]
nte interazioni chimici deboli. La capacità
dei recettori di identificare e di legarsi alle
molecole del segnale è talmente elevata che queste interazioni possono avvenire
anche quando la concentrazione del ligando [segnale] è molto piccola. Una volta
legati, il complesso recettore-molecola del segnale innesca un meccanismo di 545c23f amplificazione dovuta all'azione
di un enzima legato al recettore che provoca una cascata
enzimatica, attivando molte molecole di un secondo enzima
e poi di un terzo e così via. [vedi figura]
I sistemi di trasduzione possono essere integrati tra loro potendo ricevere segnali multipli e produrre un'unica risposta. Inoltre il prolungamento oltre le normali necessità della trasmissione del segnale si può interrompere perchè il recettore, dopo un po' di tempo si desensibilizza per un meccanismo a feedback in cui un enzima della cascata della risposta può produrre una inibizione retroattiva.
Le vie di trasduzione del segnale hanno caratteristiche comuni che possono essere così riassunte:
un segnale interagisce con il suo recettore specifico
il recettore attivato interagisce con un sistema molecolare interno che produce un nuovo segnale oppure la modificazione dell'attività di una proteina cellulare
si ha una modificazione dell'attività metabolica della cellula.
la trasduzione termina e la cellula ritorna nelle condizioni in cui era prima dell'arrivo del segnale.
tipi di trasduttori
canali ionici: fig.1) sono canali presenti in proteine di membrana che si possono aprire o chiudere in risposta ad una determinata molecola del segnale (ligando).
recettori enzimatici fig.2) sono recettori di membrana che hanno attività enzimatica e che se attivati (legame col ligando) producono a loro volta l'attivazione di un secondo messaggero intracellulare (che può essere una regione intracellulare della proteina stessa).
A questa categoria appartengono anche le proteine recettrici fig.3) (non enzimatiche) che, indirettamente regolano, attraverso altre proteine (proteina G), legate al GTP, analogo dell'ATP, l'attività di enzimi che producono un secondo messaggero intracellulare. (X)
recettori nucleari: fig.4) essi si associano al loro ligando, come gli ormoni steroidei (S), modificando la velocità di trascrizione di un gene.
Canali ionici: i recettori dell'acetilcolina.
L'acetilcolina (Ach) è un neurotrasmettitore che viene liberato, da un neurone eccitato, nello spazio sinaptico e trova il suo recettore nella membrana postsinaptica di una cellula muscolare o di una nervosa. L'Ach propaga l'impulso elettrico (potenziale d'azione) proveniente dal corpo cellulare di un neurone. Quando la depolarizzazione della membrana (interno positivo) giunge alla terminazione di un assone, si aprono i canali proteici per il Ca++ la cui elevata concentrazione determina il rilascio di Ach nello spazio sinaptico. L'acetilcolina si lega ai recettori del neurone postinaptico causando l'apertura dei canali ionici per il Na+ e propagando il potenziale d'azione.
Recettori enzimatici: il recettore dell'insulina
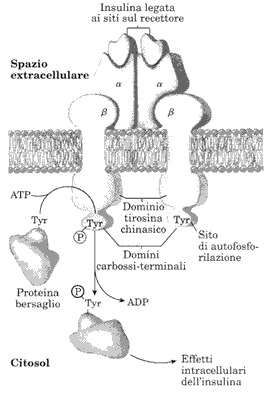 Il recettore dell'insulina, ormone pancreatico prodotto dalle
ghiandole β del pancreas, è una proteina complessa composta da 4 subunità,
due α collocate esternamente sulla superficie della membrana e due β
che attraversano la membrana e sporgono nel citosol. [vedi figura]. Una
catena α con la catena β corrispondente formano un
monomero.
Il recettore dell'insulina, ormone pancreatico prodotto dalle
ghiandole β del pancreas, è una proteina complessa composta da 4 subunità,
due α collocate esternamente sulla superficie della membrana e due β
che attraversano la membrana e sporgono nel citosol. [vedi figura]. Una
catena α con la catena β corrispondente formano un
monomero.
Le catene α contengono i siti specifici di legame dell'insulina mentre la parte citosolica delle catene β hanno un'attività enzimatica che si esplica previa la fosforilazione di alcuni residui di tirosina. Se l'insulina è legata alla subunità α, il monomero αβ provoca l'autofosforilazione nei residui di tirosina (Tyr) presenti nella catena β dell'altro monomero e ciò innesca l'attività tirosina chinasica della parte più citosolica della catena β. L'enzima ora è in grado di provocare la fosforilazione di alcuni residui di Tyr presenti in proteine bersaglio. Avviene così una cascata di fosforilazioni che coinvolge alcune proteine citosoliche che provocheranno gli effetti intracellulari dell'insulina come, ad esempio, aprire i canali per il trasporto del glucosio all'interno della cellula ed espletare l'effetto ipoglicemizzante dell'ormone.
Recettori che attivano un secondo messaggero intracellulare:
il recettore β adrenergico dell'adrenalina
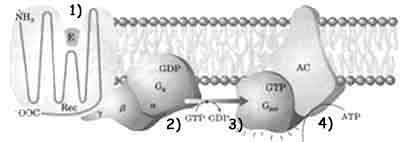
Il recettore per l'ormone adrenalina (β adrenergico) è una proteina le cui 7 eliche attraversano la membrana [vedi figura] formando quello che viene chiamato il recettore a serpentina.
Il legame con l'adrenalina (1) modifica la
conformazione del recettore che diviene in grado di catalizzare la sostituzione
del GDP (2), legato ad una proteina stimolatrice, Gs, con
il GTP. La proteina stimolatrice, composta da tre unità monomeriche, può così
lasciare le subunità β e γ e, spostandosi lungo il
piano della membrana con la sola subunità α, raggiungere una
proteina integrale di membrana chiamata adenil
c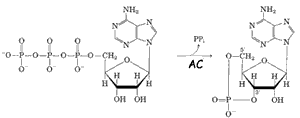 iclasi attivandola.
Il sito attivo della AC è rivolto verso il citosol e catalizza la conversione
dell'ATP in AMPc (AMP ciclico).(vedi figura a sinistra dettaglio 4)
iclasi attivandola.
Il sito attivo della AC è rivolto verso il citosol e catalizza la conversione
dell'ATP in AMPc (AMP ciclico).(vedi figura a sinistra dettaglio 4)
L'AMPc è un messaggero secondario che nel citosol stimola l'azione di una proteina chinasi AMPc dipendente (PKA) in grado di fosforilare le proteine cellulari e causare la risposta all'adrenalina.
Gli enzimi
Nel metabolismo energetico le cellule producono notevoli quantità di CO2 che deve essere eliminata con l'apparato respiratorio. Il trasferimento della CO2 dalle cellule al sangue e da esso allo spazio alveolare avviene previa idratazione del diossido di carbonio. Questo processo è spontaneo ma avverrebbe in tempi lentissimi, non fisiologici. Questa semplice reazione è catalizzata, nel nostro organismo, da un enzima altamente specifico ed efficiente, l'anidrasi carbonica. Una sola molecola può idratare 105 molecole di CO2 al secondo e la reazione è 10 milioni di volte più veloce di quella senza enzima! Solo grazie alla presenza di enzimi le trasformazioni chimiche del nostro organismo possono avvenire nei tempi e nei modi compatibili con le necessità vitali.
Gli enzimi sono proteine altamente specializzate con una funzione di catalisi estremamente specifica.
Tutte le catene o i cicli metabolici sono costituiti da una serie di passaggi e di trasformazioni, anche minime, catalizzate da sistemi multienzimatici.
Molti enzimi effettuano la loro azione solo con i residui aminoacidici di aminoacidi posti nel sito attivo e, in questo caso, sono proteine pure. Altri, invece, per la loro azione catalitica, necessitano della presenza di componenti chimici addizionali, cofattori, che possono essere ioni inorganici come il Fe2+, il Mg2+, il Mn2+, o lo Zn2+, oppure complesse molecole organiche chiamate coenzimi. Sia i cofattori che i coenzimi sono chiamati gruppi prostetici.
L'azione degli enzimi è caratterizzata da alcune proprietà fondamentali:
1) possono accelerare le reazioni anche più di un milione di volte
2) escono immodificati e di nuovo efficienti alla fine della catalisi.
3) sono efficaci in piccole quantità.
4) non influenzano l'equilibrio chimico di una reazione reversibile. Essi rendono più veloce il processo in entrambe le direzioni. L'equilibrio chimico viene semplicemente raggiunto prima.
5) sono, in genere, altamente specifici. Taluni hanno una specificità assoluta
Importanza dei cofattori
I cofattori sono i coenzimi, molecole organiche estremamente importanti per la funzione degli enzimi, in genere vitamine idrosolubili oppure gli ioni metallici che in genere operano sulla struttura enzimatica permettendole di combinarsi col substrato.
Se il coenzima è legato covalentemente alla proteina si parla di oloenzima, enzima biologicamente attivo.
La proteina prende il nome di apoenzima.
I coenzimi sono pochi e li ritroviamo, sempre gli stessi, in numerosi enzimi.
Essi si consumano nelle reazioni enzimatiche e vengono rigenerati in altre reazioni che avvengono in compartimenti cellulari diversi
Meccanismo d'azione degli enzimi
La reazione di catalisi enzimatica avviene all'interno di una "tasca" della proteina chiamata sito attivo.
La molecola che si lega all'enzima e su cui l'enzima opera si chiama substrato.
Gli enzimi, fondamentalmente, stabilizzano lo "stato di transizione (ES)" che è la specie molecolare a maggior contenuto energetico.
Si usa indicare con S il substrato su cui l'enzima opera la trasformazione (catalisi) ed E l'enzima.
Tutto il meccanismo parte dalla formazione del complesso enzima-substrato ES ed avviene secondo lo schema:
E + S ![]() ES
ES ![]() EP
EP
![]() E + P
E + P
dove ES è il complesso enzima-substrato ed EP il complesso enzima-substrato modificato, ovvero il prodotto P. La reazione è reversibile. Come si vede l'enzima esce immodificato dalla reazione e il substrato ha invece subito la trasformazione operata dall'enzima ed è il prodotto della catalisi.
Una reazione chimica spontanea avviene dopo che si è superata una barriera energetica, energia di attivazione, necessaria per favorire l'allineamento degli orbitali di legame e gli urti tra i reagenti. Tali urti, proporzionali alla concentrazione dei reagenti sono definiti urti utili. La velocità con cui questa reazione avviene dipende dal movimento casuale delle molecole che è proporzionale alla temperatura.
Gli enzimi catalizzano le reazioni abbassando l'energia di attivazione
Nelle reazioni spontanee il contenuto d'energia libera dei reagenti (substrato in questo caso) è maggiore di quella del prodotto.
Nella figura A si vede l'andamento di una reazione esoergonica (spontanea) non catalizzata. Il picco massimo è l'energia d'attivazione che occorre superare affinché la reazione proceda.
La figura B mostra l'andamento della reazione catalizzata in cui si può osservare come lo stato di transizione sia ad un livello di energia molto più bassa.
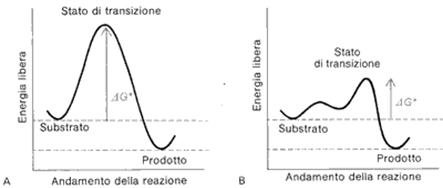
Abbassando l'energia d'attivazione, si avranno un numero superiore di molecole in grado di superarla senza ricorrere ad aumenti di temperatura.
Nel grafico (B) si possono osservare le tappe descritte e gli stati di transizione che corrispondono ai punti di maggior impegno energetico, in cui è possibile il ritorno verso i reagenti. Per questo sono i momenti più critici della reazione. I complessi ES ed EP invece sono i momenti di maggiore stabilità energetica. Superato l'ultimo stato di transizione la reazione libera il prodotto (substrato modificato) e l'enzima esce immodificato pronto per una nuova catalisi.
L'azione dell'enzima è quindi quella di abbassare l'energia di attivazione in modo selettivo "costringendo" i reagenti ad avvicinarsi, orientarne gli atomi in modo che si possano formare o rompere i legami.
Gli enzimi sono proteine globulari complesse nella cui struttura terziaria si può individuare una zona specifica, chiamata sito attivo, in cui avviene la reazione col substrato e la sua trasformazione nel prodotto specifico.
Il meccanismo d'azione dell'enzima è spesso paragonato a quello della chiave-serratura per evidenziarne la specificità. In termini molecolari è chiaro che esistono delle zone in cui, in modo altamente specifico, si possono formare legami tra la residui aminoacidici della proteina enzimatica e il substrato. Non raramente il sito attivo dell'enzima è la zona nella quale è presente il gruppo prostetico la cui funzione è sempre di primaria importanza nella catalisi.
Il modello chiave-serratura per esemplificare l'azione di un enzima è largamente intuitivo ma anche decisamente insufficiente per comprendere il delicato processo di legame di un enzima con il suo substrato, la catalisi e la liberazione del prodotto.
Ci possiamo chiedere come è possibile questo enorme aumento della velocità indotto dagli enzimi. e da dove arriva l'energia necessaria ad abbassare l'energia d'attivazione di una reazione?
I gruppi funzionali nel sito attivo (residui aminoacidici, ioni metallici, coenzimi) reagiscono col substrato generando una via della reazione a bassa energia ricavata dalle numerose interazioni deboli non covalenti, le stesse che stabilizzano le proteine: legami idrogeno, forze di van Der Waals, interazioni idrofobiche ed ioniche. Queste interazioni, esoergoniche, sono fondamentali per la formazione del complesso ES e ne determinano la stabilità La somma di questo rilascio di piccole quantità di energia, chiamata energia di legame, è la fonte principale di energia libera necessaria per abbassare l'energia d'attivazione. In definitiva, le interazioni deboli che portano alla formazione del complesso ES sono le forze che contribuiscono alla catalisi. Per avere la massima efficacia l'enzima dovrà avere solo una parziale complementarietà al S ma dovrà essere totalmente complementare allo stato di transizione ES.
Così anche la elevata specificità di un enzima, che è la proprietà di distinguere molecole simili, si può spiegare con la caratteristica disposizione dei gruppi funzionali nel sito attivo che se formano interazioni perfette con un determinato substrato nello stato di transizione, non potranno farlo con un substrato simile ma non identico. Da un punto di vista strettamente molecolare il sito attivo si orienta in modo tale da portare i gruppi specifici del sito attivo in condizioni di massima efficienza per la catalisi. Questo adattamento porta ad una modificazione conformazionale dell'enzima indotta da uno specifico substrato.
 Cinetica enzimatica
Cinetica enzimatica
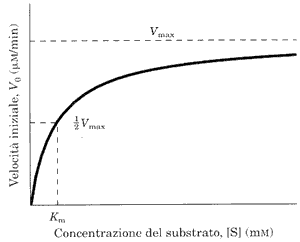
Lo studio della velocità delle reazioni catalizzate da enzimi parte considerando gli effetti della [ S ], concentrazione del substrato che , naturalmente, varia nel corso della reazione essendo S trasformato in P. Allora ponendo in vitro una [ S ] molto superiore a quella dell'enzima si può calcolare la V0 , velocità iniziale, considerando la variazione di [ S ] trascurabile.
Il grafico mostra l' effetto dell'aumento della concentrazione di substrato sulla velocità iniziale di una reazione catalizzata da un enzima.
La velocità aumenta esponenzialmente fino a raggiungere un plateau che rappresenta la velocità massima che non varia anche con aggiunte successive di substrato.
Questa velocità si raggiunge quando tutto l'enzima è saturato dal substrato.
La velocità della reazione è data dall'equazione di Michaelis-Menten che lega la velocità ad una costante , la Km, caratteristica per ogni enzima e che è utile conoscere perché ci fornisce una misura dell'affinità di un enzima per il suo suo substrato.
Vmax [S]
V0 =
Km [S]
Poiché è difficile calcolare la velocità massima, ci conviene calcolare 1/2Vmax, sostituendo questo valore a V0.
2 Vmax [S]
da cui sostituendo: Km [S] = e quindi Km = [S] quando V0 = 1/2Vmax
Vmax
Dalla relazione si evince che gli enzimi con una Km alta, hanno una minore affinità per il loro substrato e viceversa.
L'esochinasi, enzima presente nelle cellule del cervello, ha una Km di circa 400 volte più piccola della glucochinasi che catalizza la stessa reazione nel fegato: la fosforilazione del glucosio. Il motivo risiede nelle piccole concentrazioni di glucosio presenti nel circolo encefalico e dalla necessità che le cellule nervose hanno di utilizzarlo anche in basse concentrazioni.
Gli inibitori enzimatici
Gli enzimi, oltre a catalizzare le reazioni, intervengono nei processi di regolazione metabolica. Quindi saranno necessari meccanismi di attivazione o di inibizione enzimatica.
Le sostanze che inibiscono gli enzimi sono potenti agenti farmacologici. Per esempio l'aspirina inibisce il primo enzima della sintesi delle prostaglandine che partecipano al processo della produzione del dolore.
La regolazione enzimatica
È chiaro che in un organismo le vie metaboliche debbano funzionare con una coordinazione tale che siano attive solo quelle necessarie al momento e inibite quelle che non servono, in quel momento, alla vita di una cellula.
Vi sono enzimi particolari che operano nella catena metabolica, attivandola o inibendola secondo la richiesta e la concentrazione ottimale del prodotto finale che concorrono a produrre.
A sua volta questo importante enzima chiamato enzima regolatore, è controllato dall'organismo attraverso vari sistemi come la stimolazione o l'inibizione a produrre quel determinato enzima mediante ormoni o neurotrasmettitori.
L'enzima regolatore determina quindi la velocità complessiva di una catena metabolica.
Nelle vie metaboliche vi sono due classi di enzimi regolatori: gli enzimi allosterici che agiscono mediante un legame reversibile di un metabolita regolatore chiamato modulatore o effettore e gli enzimi regolati mediante modificazioni covalenti reversibili.
Gli enzimi allosterici
Gli enzimi allosterici hanno quasi sempre una struttura quaternaria (più subunità polipeptidiche) e possiedono, oltre al sito attivo in una subunità, anche un altro sito, sito regolatore in un'altra subunità, al quale si lega l'effettore (o modulatore).
L'enzima esiste in due configurazioni tra loro convertibili. In una subunità troviamo il sito regolatore che può essere nella configurazione attivata oppure in quella inattivata. Se il modulatore induce una attivazione della catena metabolica allora esso si lega al sito regolatore dell'enzima stimolando il sito attivo, situato generalmente in altra subunità, a legarsi col substrato. Al contrario, se il modulatore è un inibitore, si avrà la perdita di affinità sul sito attivo dell'enzima. Tale condizione determina il blocco della via metabolica.
Inibizione allostrerica
In alcuni sistemi multienzimatici l'enzima regolatore viene inibito in modo specifico dal prodotto finale della via, quando tale prodotto si accumula oltre le necessità delle cellule. In genere l'enzima allosterico è il primo della via metabolica. Questa inibizione si chiama inibizione retroattiva o inibizione da prodotto (meccanismo a feedback).
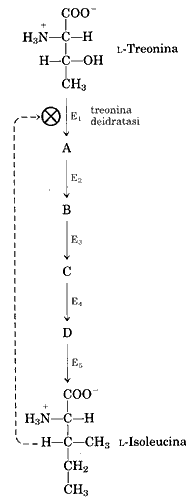
Nei batteri è attiva una via metabolica che converte, attraverso cinque reazioni, un aminoacido, la L-treonina in un altro aminoacido, la isoleucina. Il primo enzima di questa via metabolica è la treonina deidratasi (E1) e viene inibito allostericamente, con meccanismo a feedback , dalla isoleucina.
È ovvio che quando la Isoleucina, che funziona da effettore o modulatore, viene utilizzata dalla cellula e la sua concentrazione diminuisce, essa si stacca dall'enzima allosterico che ritorna nella conformazione attivata e il sito attivo ritorna affine alla L-Treonina e la via metabolica riprende la sua attività.
La cinetica enzimatica, con gli enzimi
allosterici, ci fornisce curve di velocità con andamento sigmoide e non
iperbolico. Il valore della Vmax non cambia mentre cambia quello
della Km che diminuisc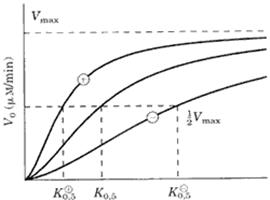 e in caso di effettore positivo ed aumenta in caso di effettore
negativo.
e in caso di effettore positivo ed aumenta in caso di effettore
negativo.
Altri meccanismi di regolazione enzimatica si hanno quando l'enzima viene modificato covalentemente da alcuni gruppi chimici come il fosfato, l'adenosina monofosfato, l'uridina monofosfato e i gruppi metilici. Questi gruppi possono legarsi all'enzima ed essere rimossi da altri enzimi. Un enzima appartenente a questa categoria è la glicogeno fosforilasi che regola nel muscolo e nel fegato il processo di demolizione del glicogeno.
Un esempio interessante del meccanismo di regolazione enzimatica è dato da due effettori importanti come la calmodulina, in tutte le cellule, e la troponina nelle cellule muscolari.
Essi sono attivati, all'interno delle cellule, dalla presenza di ioni Ca2+ che è normalmente bassa rispetto a quella dell'ambiente extracellulare con un gradiente di circa 10.000 volte. La cellula, in condizioni normali, non fa passare gli ioni Ca, opponendosi alla naturale tendenza mantenendo chiusi i canali proteici. Sappiamo che la contrazione muscolare avviene quando la cellula apre i canali proteici agli ioni Ca2+ ; in queste condizioni la troponina viene attivata, altrimenti, vista la bassa concentrazione degli ioni Ca, essa è una molecola inattiva.
Un segnale nervoso fa aprire i canali proteici, gli ioni Ca2+ passano attraverso la membrana e si legano alla troponina che viene così attivata. La troponina, funziona da effettore attivando un enzima che determina la contrazione muscolare. In questo meccanismo è interessante notare la connessione che c'è tra un segnale nervoso e la sua "traduzione" in attività chimica precisa.
La concentrazione degli enzimi allosterici è generalmente molto bassa nelle cellule e la loro sintesi viene stimolata o inibita da specifici ormoni che operano a livello genico.
L'insulina, ad esempio esplica la sua azione stimolando la sintesi degli enzimi glucochinasi, fosfofruttochinasi e glicogeno sintetasi, reprimendo quella degli enzimi della biosintesi del glucosio, rispettando il suo effetto ipoglicemizzante.
È interessante osservare che le vie anaboliche e quelle cataboliche sono sempre localizzate in organelli e compartimenti cellulari diversi in modo che gli enzimi che controllano una via catabolica, non controllino contemporaneamente anche quella anabolica.
La compartimentazione è un metodo efficiente della gestione dell'attività cellulare.
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2024