|
|
| |
RELAZIONE SULLA TERZA ESPERIENZA DI
CHIMICA 1 E LABORATORIO
ESERCIZIO N° 1:
Durezza totale
Prima
di iniziare l'esperienza, ci è stata consegnata una soluzione incognita di
Acqua (![]() ). Si avvina la buretta con
l'aggiunta di una piccola quantità di soluzione di EDTA (Acido
etilendiamminotetraacetico) 0,01 M; si carica con quest'ultima soluzione e si
legge il volume iniziale (per convenienza si è partiti da 0 ml). Si trasferisce
dalla beuta da 100 ml in un beaker da 250 ml un volume noto (25 ml esatti)
della soluzione di Acqua con l'ausilio della pipetta tarata a doppia tacca. Si
aggiungono 5 ml di una soluzione tampone di
). Si avvina la buretta con
l'aggiunta di una piccola quantità di soluzione di EDTA (Acido
etilendiamminotetraacetico) 0,01 M; si carica con quest'ultima soluzione e si
legge il volume iniziale (per convenienza si è partiti da 0 ml). Si trasferisce
dalla beuta da 100 ml in un beaker da 250 ml un volume noto (25 ml esatti)
della soluzione di Acqua con l'ausilio della pipetta tarata a doppia tacca. Si
aggiungono 5 ml di una soluzione tampone di ![]() a pH = 10 e cinque gocce di indicatore Nero
Eriocromo T (NET). Si comincia a titolare tale soluzione con aggiunta di poche
gocce di EDTA alla volta, sino a che avviene il viraggio dell'indicatore
facendo passare la soluzione da un col 656j93g ore rosso vino ad blu. A questo punto, si
legge il valore del volume a cui si è giunti (5,60 ml). Si ripete nuovamente la
stessa esperienza su una seconda frazione di campione di acqua e si legge il
volume a cui l'indicatore ha virato (5,90 ml). Si calcola la durezza totale di
tale campione d'acqua:
a pH = 10 e cinque gocce di indicatore Nero
Eriocromo T (NET). Si comincia a titolare tale soluzione con aggiunta di poche
gocce di EDTA alla volta, sino a che avviene il viraggio dell'indicatore
facendo passare la soluzione da un col 656j93g ore rosso vino ad blu. A questo punto, si
legge il valore del volume a cui si è giunti (5,60 ml). Si ripete nuovamente la
stessa esperienza su una seconda frazione di campione di acqua e si legge il
volume a cui l'indicatore ha virato (5,90 ml). Si calcola la durezza totale di
tale campione d'acqua:
![]()
![]()
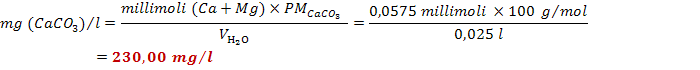
Sapendo che la durezza è calcolata in gradi francesi, i quali sono eguali a:
![]()
da questo si ricava che la durezza
della soluzione incognita del campione di acqua è ![]() . In base alla tabella della
durezza, si può dire che il campione di acqua può essere classificato come ACQUA MOLTO
DURA
. In base alla tabella della
durezza, si può dire che il campione di acqua può essere classificato come ACQUA MOLTO
DURA
|
DOLCISSIME |
|
|
DOLCI |
|
|
DURE |
|
|
MOLTO DURE |
|
|
DURISSIME |
|
Determinazione
delle concentrazioni di ![]()
Si trasferisce dalla beuta da 100 ml
in un beaker da 250 ml un volume noto (25 ml esatti) della soluzione di Acqua
con l'ausilio della pipetta tarata a doppia tacca. In tale recipiente di
aggiunge una pasticca di NaOH e si agita accuratamente sino a far precipitare ![]() (in tale esperienza, tale precipitato non è
stato visibile). Si aggiunge nel beaker un granello di indicatore muresside, il
quale, al punto di viraggio, fa cambiare il colore della soluzione da rosa a
violetto. Si carica la buretta con l'aggiunta di una piccola quantità di
soluzione di EDTA (Acido etilendiamminotetraacetico) 0,01 M; si legge il volume
iniziale (per convenienza si è partiti da 0 ml). Si comincia a titolare tale
soluzione con aggiunta di poche gocce di EDTA alla volta, sino a che avviene il
viraggio dell'indicatore facendo passare la soluzione da un col 656j93g ore rosa a
violetto; a questo punto, si agita accuratamente la soluzione (per evitare la
perdita di calcio) e si legge il volume a cui l'indicatore ha virato (3,0 ml).
Si ripete nuovamente la stessa esperienza su una seconda frazione di campione
di acqua e si legge il volume a cui l'indicatore ha virato (3,10 ml). Si
calcola la concentrazione di
(in tale esperienza, tale precipitato non è
stato visibile). Si aggiunge nel beaker un granello di indicatore muresside, il
quale, al punto di viraggio, fa cambiare il colore della soluzione da rosa a
violetto. Si carica la buretta con l'aggiunta di una piccola quantità di
soluzione di EDTA (Acido etilendiamminotetraacetico) 0,01 M; si legge il volume
iniziale (per convenienza si è partiti da 0 ml). Si comincia a titolare tale
soluzione con aggiunta di poche gocce di EDTA alla volta, sino a che avviene il
viraggio dell'indicatore facendo passare la soluzione da un col 656j93g ore rosa a
violetto; a questo punto, si agita accuratamente la soluzione (per evitare la
perdita di calcio) e si legge il volume a cui l'indicatore ha virato (3,0 ml).
Si ripete nuovamente la stessa esperienza su una seconda frazione di campione
di acqua e si legge il volume a cui l'indicatore ha virato (3,10 ml). Si
calcola la concentrazione di![]() (per differenza):
(per differenza):
![]()
![]()
![]()
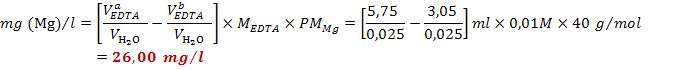
Ragion per cui, il campione di acqua analizzato può essere classificato come ACQUA NON POTABILE, poiché il rapporto ponderale Mg: Ca supera il valore massimo di potabilità 2 : 5. Questo indica che la percentuale di Mg nel campione è superiore e spesso è dovuto alla presenza di sostanze organiche di natura vegetale in decomposizione, come la clorofilla, la quale contiene magnesio.
ESERCIZIO N° 2:
Durezza totale
Si carica la buretta con l'aggiunta
di una piccola quantità di soluzione di EDTA (Acido etilendiamminotetraacetico)
0,01 M; si legge il volume iniziale (per convenienza si è partiti da 0 ml). Si
trasferisce dalla beuta da 100 ml in un beaker da 250 ml un volume noto (25 ml
esatti) della soluzione di Acqua del rubinetto del laboratorio con l'ausilio
della pipetta tarata a doppia tacca. Si aggiungono 5 ml di una soluzione
tampone di ![]() a pH = 10 e cinque gocce di indicatore Nero
Eriocromo T (NET). Si comincia a titolare tale soluzione con aggiunta di poche
gocce di EDTA alla volta, sino a che avviene il viraggio dell'indicatore
facendo passare la soluzione da un col 656j93g ore rosso vino ad blu. A questo punto, si
legge il valore del volume a cui si è giunti (8,00 ml). Si ripete nuovamente la
stessa esperienza su una seconda frazione di campione di acqua e si legge il
volume a cui l'indicatore ha virato (8,30 ml). Si calcola la durezza totale di
tale campione d'acqua:
a pH = 10 e cinque gocce di indicatore Nero
Eriocromo T (NET). Si comincia a titolare tale soluzione con aggiunta di poche
gocce di EDTA alla volta, sino a che avviene il viraggio dell'indicatore
facendo passare la soluzione da un col 656j93g ore rosso vino ad blu. A questo punto, si
legge il valore del volume a cui si è giunti (8,00 ml). Si ripete nuovamente la
stessa esperienza su una seconda frazione di campione di acqua e si legge il
volume a cui l'indicatore ha virato (8,30 ml). Si calcola la durezza totale di
tale campione d'acqua:
![]()
![]()
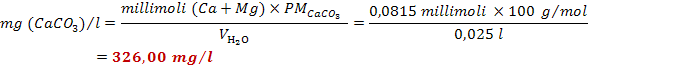
Sapendo che la durezza è calcolata in gradi francesi, i quali sono eguali a:
![]()
da questo si ricava che la durezza
della soluzione incognita del campione di acqua è ![]() . In base alla tabella della
durezza, si può dire che il campione di acqua può essere classificato come ACQUA MOLTO
DURA
. In base alla tabella della
durezza, si può dire che il campione di acqua può essere classificato come ACQUA MOLTO
DURA
|
DOLCISSIME |
|
|
DOLCI |
|
|
DURE |
|
|
MOLTO DURE |
|
|
DURISSIME |
|
Determinazione
delle concentrazioni di ![]()
Si trasferisce dalla beuta da 100 ml in un beaker da 250 ml un volume noto (25 ml esatti)
della soluzione di Acqua del
rubinetto del laboratorio con l'ausilio della pipetta tarata a doppia tacca. In
tale recipiente di aggiunge una pasticca di NaOH e si agita accuratamente sino
a far precipitare ![]() (in tale esperienza, tale precipitato non è
stato visibile). Si aggiunge nel beaker un granello di indicatore muresside, il
quale, al punto di viraggio, fa cambiare il colore della soluzione da rosa a
violetto. Si carica la buretta con l'aggiunta di una piccola quantità di
soluzione di EDTA (Acido etilendiamminotetraacetico) 0,01 M; si legge il volume
iniziale (per convenienza si è partiti da 0 ml). Si comincia a titolare tale
soluzione con aggiunta di poche gocce di EDTA alla volta, sino a che avviene il
viraggio dell'indicatore facendo passare la soluzione da un col 656j93g ore rosa a
violetto; a questo punto, si agita accuratamente la soluzione (per evitare la
perdita di calcio) e si legge il volume a cui l'indicatore ha virato (6,55 ml).
Si ripete nuovamente la stessa esperienza su una seconda frazione di campione
di acqua e si legge il volume a cui l'indicatore ha virato (6,70 ml). Si
calcola la concentrazione di
(in tale esperienza, tale precipitato non è
stato visibile). Si aggiunge nel beaker un granello di indicatore muresside, il
quale, al punto di viraggio, fa cambiare il colore della soluzione da rosa a
violetto. Si carica la buretta con l'aggiunta di una piccola quantità di
soluzione di EDTA (Acido etilendiamminotetraacetico) 0,01 M; si legge il volume
iniziale (per convenienza si è partiti da 0 ml). Si comincia a titolare tale
soluzione con aggiunta di poche gocce di EDTA alla volta, sino a che avviene il
viraggio dell'indicatore facendo passare la soluzione da un col 656j93g ore rosa a
violetto; a questo punto, si agita accuratamente la soluzione (per evitare la
perdita di calcio) e si legge il volume a cui l'indicatore ha virato (6,55 ml).
Si ripete nuovamente la stessa esperienza su una seconda frazione di campione
di acqua e si legge il volume a cui l'indicatore ha virato (6,70 ml). Si
calcola la concentrazione di![]() (per differenza):
(per differenza):
![]()
![]()
![]()
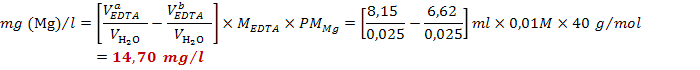
Ragion per cui, il campione di acqua analizzato può essere classificato come ACQUA NON POTABILE, poiché il rapporto ponderale Mg: Ca è inferiore al valore minimo di potabilità 1 : 5.
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2024