|
|
| |
Relazione di lab. Chimica N°4
Obiettivo
Osservazioni di reazioni di composti mediante reazione chimica di ossidoriduzione.
Materiale occorrente
Sostanze
Acido cloridrico
Zinco metallico
Soluzione di Nitrato d'Argento
Filo di Rame
Vetreria
2 Provette
Procedimento
1° Sperimentazio 242g61c ne: Prendiamo dell'acido cloridrico e ne versiamo una determinata quantità nella provetta dove vi aggiungeremo anche dello Zinco metallico. Quindi ne osserviamo l'eventuale reazione.
2° Sperimentazione Versiamo la soluzione di Nitrato d'Argento nella provetta dove infileremo un pezzetto di filo di rame a forma di spirale. Il filo dovrà stare per metà nella soluzione di Nitrato d'Argento mentre l'altra metà all'esterno per osservarne meglio la reazione.
![]() Elaborazione dati
Elaborazione dati
![]() Zn + 2HCl ZnCl2 + H2
Zn + 2HCl ZnCl2 + H2
![]() 2Ag(NO)3 + Cu Cu
(NO3) 2 + 2Ag
2Ag(NO)3 + Cu Cu
(NO3) 2 + 2Ag
Osservazioni e conclusioni
Nella prima reazione tra i granelli di Zinco e acido cloridrico, abbiamo notato un'effervescenza dovuta dalla liberazione di idrogeno, con la formazione di Cloruro di Zinco.
Nella seconda reazione abbiamo notato la formazione di una "peluria", in realtà dei piccoli aghetti intorno al filo di rame bagnato da Nitrato d'Argento e il cambio di colore dello stesso, da arancione a nerastro.
Entrambe le reazioni sono di ossidoriduzione: nella prima l'elemento ossidato è l'idrogeno che ha perso un elettrone, mentre quello che si riduce è lo Zinco che di elettroni ne ha acquistati due. La seconda reazione vede il Rame come ossidato che ha perso tre elettroni, mentre l'argento che di elettroni ne acquista uno è quello che si riduce.
Reazioni di ossidoriduzióne Reazione chimica in cui un riducente si ossida a opera di un ossidante e questo si riduce a opera del riducente.
Le reazioni di ossidoriduzione si possono considerare costituite da due equazioni elettroniche parziali nelle quali si fanno intervenire esplicitamente gli elettroni. Per es. la reazione 2Fe³ +Sn² D 2Fe² +Sn può essere considerata come la somma delle reazioni:
2Fe³ + 2e D2Fe²
Sn² DSn + 2e
in cui e indica la carica (negativa) dell'elettrone.
Si possono così indicare le coppie di ossidoriduzione:
Fe² Fe³ + e
Sn² Sn + 2e
considerando questo sistema in equilibrio poiché se lo ione ferrico è ridotto dallo ione stannoso, lo ione ferroso può essere ossidato per es. dal cloro (Cl Cl+e ). Classificare gli ossidanti e i riducenti secondo la loro forza vuol dire, più semplicemente, scrivere una serie ordinata di coppie di ossidoriduzione. Questa serie potrebbe essere costruita con dati puramente chimici, ma è più utile servirsi della teoria delle pile che fornisce, con la nozione di potenziale di elettrodo, una classificazione quantitativa delle coppie redox.
Le pile elettrochimiche sono dei generatori di corrente il cui funzionamento è determinato da reazioni di ossidoriduzione. Si consideri per es. la pila Daniell
Zn/ZnSO CuSO /Cu.
Quando la pila produce corrente gli elettroni circolano, esternamente, dallo zinco al rame e, internamente, dal rame allo zinco; tale trasporto è effettuato da ioni e da scambi a livello degli elettrodi: l'elettrodo positivo (Cu) cede a uno ione Cu² due elettroni che lo trasformano in atomo Cu, il quale si deposita sull'elettrodo: Cu² +2e DCu; contemporaneamente l'elettrodo negativo (Zn) accoglie due elettroni provenienti dalla trasformazione di un atomo Zn in ione Zn² che passa in soluzione: ZnDZn² +2e
ossidoriduzione
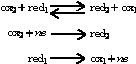
reazione che comporta una variazione significativa dell'elettronegatività relativa tra un dato atomo e gli atomi coi quali risulta legato prima e dopo la reazione, e una variazione opposta nei confronti degli atomi coi quali l'atomo in questione è entrato in contatto. La reazione di o. è pertanto la combinazione di due semireazioni, una di ossidazione e una di riduzione: nel complesso il numero (n) di elettroni (e) acquistati dalla specie ossidante (ox), che pertanto si riduce, deve essere uguale al numero di elettroni ceduti dal datore di elettroni, la specie riducente (red), che quindi si ossida.
 _[1v\h8"f16_98.wmf"_[0v
_[1v\h8"f16_98.wmf"_[0v
Ordinando i potenziali standard degli elettrodi presentati dalle specie ossidanti e riducenti (scala dei potenziali redox) in modo che il potere riducente decresca dall'alto verso il basso, mentre cresce quello ossidante, un dato agente ossidante è in grado di ossidare tutti i riducenti che lo precedono, mentre un dato agente riducente è capace di ridurre tutti gli ossidanti che lo seguono. Si può pertanto, conoscendo i potenziali elettrodici di due semireazioni qualsiasi, stabilire in quale senso la reazione globale tende a procedere spontaneamente.
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2024