|
|
| |
LO STATO GASSOSO
Si può considerare un sistema gassoso come un insieme di particelle , ciascuna dotata di massa e volume, confinate in uno spazio ampio ma limitato, aventi un'elevata energia che le fa muovere con una certa velocità, esse si muovono indipendentemente allontanandosi, talora urtand 242i82c osi. Il tutto avviene casualmente.
Il concetto di gas ideale si basa su una serie di assunzioni:
a) Le particelle del gas sono animate da moto perenne;
b) Il movimento delle particelle è regolato dalle leggi del caso;
c) Le particelle hanno un volume proprio trascurabile;
d) Fra le particelle non esistono interazioni;
e) Gli urti tra le particelle sono completamente elastici.
I gas ideali hanno un comportamento semplificato rispetto ai gas reali.
Per i gas si definisce uno stato standard: il gas si trova alla pressione di 1 atm e ad una temperatura T costante, che per convenzione è di 25°C, cioè 298 K.
Per descrivere il comportamento dei gas ideali sono state formulate attraverso numerose osservazioni sperimentali.
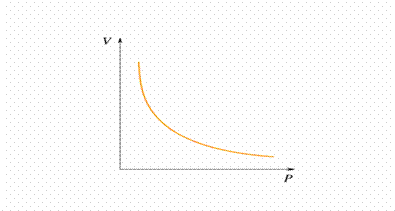
LEGGE DI BOYLE (legge dell'isoterma)
A temperatura costante il volume occupato da una determinata massa di gas è inversamente proporzionale alla pressione:
(PV)T,n = costante
P = pressione = forza / superficie 1 atm ↔ 760 mmHg SI = N/m2
1 atm → 101.325 = 101325 N/m2 = Kpa
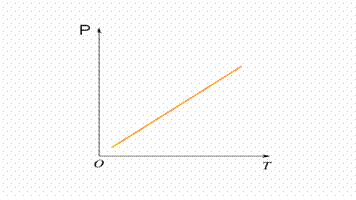
LEGGE DI VOLTA - GAY LUSSAC (legge dell'isocora)
Quando una determinata massa di gas viene riscaldata a volume costante, per ogni aumento di temperatura di 1°C la pressione aumenta di 1/273 rispetto al valore che essa aveva a 0°C.
( V t) P = V0(1+at)
Alfa (a)=1/273,15 V0= 0°C
Di conseguenza la risulta che V = V0((273,15+t)/273,15)
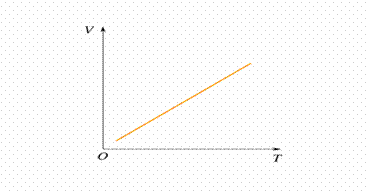
LEGGE DI CHARLES ( legge dell'isobara )
Quando una determinata massa di gas viene riscaldata a pressione costante, per ogni aumento di temperatura di 1°C il volume aumenta di 1/273,15 rispetto al valore che essa aveva a 0°C.
( P t) v = P0(1+at)
Questa formula è chiamata anche seconda legge di G. Lussac.
LEGGE DI AVOGADRO
Volumi uguali dello stesso gas o di gas diversi contengono un ugual numero di particelle. A temperatura costante il numero di moli n di un gas direttamente proporzionale al volume V occupato dal gas.
V = k n
Con questa legge è possibile determinare i pesi molecolari relativi ad una certa sostanza presa come rifermento.
P1=P2(M1 tot/M2tot)
LEGGE DI STATO DEI GAS IDEALI
Questa equazione mette in relazione tra loro pressione, temperatura e volume.
Condizioni iniziali:
Temperatura = 0°C Pressione = P0 Volume = V0
Se sul gas si opera un riscaldamento a pressione costante fino alla temperatura di t ° C, si può utilizzare la legge di Charles.
Dopo la trasformazione il gas presenterà il seguente stato:
Temperatura = t ° C Pressione = P0 Volume = Vt
A questo punto si fa una variazione di pressione fino ad un valore P applicando la legge di Boyle
Pertanto il gas si presenterà in questo modo:
Temperatura = t ° C Pressione = P Volume = V1
Di conseguenza si avrà la seguente espressione:
PV = nRT
P = Pressione
V = Volume
n = Numero di moli
R = Costante universale dei gas = 0,082 → 8,2053 * 10-2 (dm3 atm)/(mol K)
LA TEORIA CINETICA DEI GAS
La teoria cinetica dei gas rappresenta un metodo alternativo che consente di arrivare alla formulazione dell'equazione di stato dei gas e a tutte le altre leggi.
a) Moto cinetico
b) No interazioni tra molecole
Le molecole dei gas vengono considerate sferiche ed in un determinato momento si pensa che il numero degli urti sia pari a 1010 .
Secondo questa teoria non tutte le molecole ad un determinato momento hanno energia e velocità costante ed a temperatura ambiente risulta costante il numero di molecole che hanno la stessa velocità.
DISTRIBUZIONE DI MAXWELL-BOLTZMANN
La distribuzione di Maxwell-Boltzmann è una funzione di distribuzione delle particelle con una certa energia, in un sistema che obbedisce alle leggi della fisica classica: fornisce cioè la probabilità che una particella abbia una energia compresa fra E ed E + dE, oppure una velocità compresa fra v e v + dv
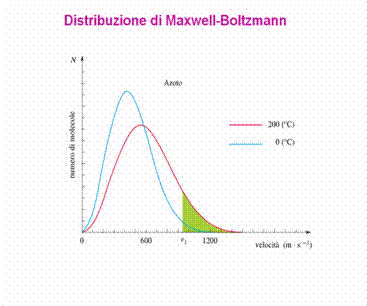
F (v) = 4 p (m / 2 p k T)3/2 v2 exp( m v2 / 2 k T)
vmax = velocità più probabile = (2 k T / m)1/2
v = velocità media = (8 k T / p m)1/2
v = 1.28 vmax
Z = frequenza di collisione = 4 (N / V) d2 (8 k T / p m)1/2
l = libero cammino medio = 1 / [21/2 d2 (N / V)]
RELAZIONE TRA ENERGIA CINETICA E TEMPERATURA
Supponendo una mole di gas
N1/2 m v2 = 3/2PV
Em = N1/2 m v2
PV = RT
Em = 3/2 RT
N ½ m v2 = 3/2 R T
½ m v2 = 3/2 k T
k = R / N = 1.38 10 J/K = costante di Boltzmann
I GAS REALI - L'EQUAZIONE DI VANDER WAALS
L'equazione dei gas può essere adattate per descrivere il comportamento dei gas reali.
P + a (n2 / V2) (V - n b) = n R T
In questa equazione però compaiono dei termini correttivi:
(n2+a)/V2 viene chiamato pressione interna o di coesione tiene conto del fatto che esistono forze attrattive tra le molecole, le quali fanno diminuire la pressione che esse eserciterebbero se il gas si comportasse in modo ideale.
B è il covolume o volume proprio della molecola e tiene conto del fatto che a differenza di un gas ideale, in un gas reale le molecole non sono puntiformi ma hanno un volume proprio.
L'equazione di van der Waals però ha una validità limitata, infatti in condizioni di pressione elevata o di temperatura bassa essa va sostituita con relazioni più complesse.
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2024