|
|
| |
La FISICA e la CHIMICA sono due scienze che indagano la materia, ma mentre la
fisica studia le proprietà della materia, i fenomeni naturali e le leggi che li
governano , la chimica studia la materia
e le sue trasformazioni.
Come si vede già dalle definizioni proposte la materia è oggetto di studio da parte di entrambe le discipline e benché da angolazioni diverse queste a volta si sovrappongono tanto che in molti indirizzi di studi superiori (come il nostro in quarta e quinta) od università esiste il corso di Chimica-Fisica che tratta lo studio di proprietà e fenomeni oggetto di entrambe le discipline e che già in questo corso elementare cominceremo a conoscere. In questi appunti non si insisterà pertanto sulla netta distinzione fra fenomeno chimico e fenomeno fisico , ma si sfumeranno i concetti in particolare inserendo fra i due tipi il fenomeno chimico - fisico.
Cos'è dunque la materia? E' tutto ciò che ci circonda, ha peso, volume e si rivela ai nostri sensi. La materia può esistere in uno dei tre stati principali di aggregazione (solido, liquido, aeriforme). La differenza fra il concetto scientifico di materia e quello dell'uomo comune è proprio sul fatto che noi considereremo materia anche l'aria la quale come vedremo rientra appieno nella definizione su riportata.
Le proprietà della materia possono distinguersi approssimativamente in cinque gruppi:
Organolettiche che si rivelano ai sensi (colore, odore, sapore)
Tecnologiche : lavorabilità, durezza , ecc.
Fisiche : densità , conducibilità elettrica e termica, T di fusioneecc. .
Chimiche: composizione, reattività.
Biologiche : (solo per sostanze di origine vegetale o animale)
Tralasciando le proprietà biologiche, si accennerà a quelle organolettiche e tecnologiche mentre si concentrerà la nostra attenzione su quelle fisiche e chimiche. Per le proprietà fisiche si rimanda agli appunti di laboratorio, per quelle chimiche c'è bisogno di una introduzione che innanzitutto le chiarisca.
La composizione della materia non è infatti né una cosa chiara, né facile da classificare. Cominciamo con un esempio: se comperiamo una scatola di biscotti e ne leggiamo la composizione vediamo ad esempio che questi sono fatti con : latte, burro , uova, farina , miele, sale, polvere lievitante, aromi naturali. Ma questi componenti non sono ancora sostanze semplici, il latte ad esempio contiene acqua ma anche proteine , grassi, zuccheri e perfino elementi minerali quali ferro, calcio, fosforo e vitamine varie. Alcune di queste sostanze es. i grassi sono formati da sostanze più semplici - acidi grassi e glicerina- anch'essi costituiti da molecole contenenti carbonio, idrogeno ed ossigeno in determinate posizioni e quantità; solo queste ultime sostanze non sono costituite da specie più semplici e vengono pertanto detti elementi o sostanze pure semplici.
Oggi sappiamo tutto ciò grazie a lunghi ed impegnativi studi, ma ovviamente non è sempre stato così, basti pensare che solo nel 18° secolo si è iniziato ad avere qualche cognizione scientifica della costituzione della materia.
Nel 5° secolo A.C. il filosofo Empedocle di Agrigento aveva pensato la materia costituita da quattro sostanze: acqua, aria, terra, fuoco ai quali Aristotele un secolo più tardi aggiunse l'etere. Teoria questa che grazie all'autorevolezza dei suoi ideatori durò fino al tardo medioevo. E' vero che Democrito (filosofo di Abdera) aveva introdotto nel 5° secolo A.C. la teoria atomistica (da atomo = indivisibile) dove contrapponendo la divisione fisica (finita) a quella matematica (infinita supponeva dei corpi semplici alla base dei corpi composti)
Democrito però non aveva gli strumenti scientifici per suffragare la propria intuizione e la sua teoria per quanto ben spiegata filosoficamente non ebbe la fortuna di quella di Aristotele. Prescindendo dal percorso storico , interessante ma difficile da seguire (andrebbe fuori anche dal limite di spazio che ci siamo proposti) ci limitiamo a definire, secondo la scienza moderna, alcuni termini già incontrati in questa introduzione,.
ATOMO: particella chimicamente indivisibile, compone la materia e partecipa alle reazioni chimiche.
L'aggettivo "chimicamente 828h79i " davanti ad inscindibile è stato aggiunto dopo che Fermi nel 1941 costruì la pila atomica, sistema di produzione di energia sfruttando appunto la scissione dell'atomo.
ELEMENTO: Sostanza costituita da atomi tutti uguali, non divisibili in qualità diverse. Sono elementi l'ossigeno il ferro, il piombo non lo è l'acqua.
MOLECOLA: E' la più piccola unità di materia che mantiene inalterata le sue caratteristiche. Può essere formata da atomi tutti della stessa specie ( molecola semplice es. O2, ossigeno ) o di specie diverse (molecola composta es. H2O, acqua)
COMPOSTO: Sostanza costituita da due o più elementi uniti insieme in quantità definite e costanti. E' formato da molecole tutte uguali. Es. H2O, NaCl (cloruro di sodio). Per ogni atomo di cloro ci dovrà esserci un atomo di sodio, per un milione di atomi di cloro, un milione di atomi di sodio (non uno in più , non uno in meno, come in un milione di coppie sposate ci saranno esattamente un milione di uomini ed un milione di donne). Similmente nell'acqua ci saranno per ogni atomo di ossigeno esattamente due atomi di idrogeno (come ogni figlio è nato da due genitori, non da uno, non da tre).
La specificazione vista sopra ci serve a capire la differenza fra composto e lega di cui avrai sentito parlare in educazione tecnica:
LEGA sostanza costituita da due o più elementi uniti insieme in quantità approssimativamente definite. Esempi sono il Bronzo formato da Rame (Cu) e Stagno (Sn), l'ottone formato da rame e zinco (Zn) la ghisa e l'acciaio formati da ferro (Fe) e carbonio (C). Se la ghisa e l'acciaio sono formati in prima approssimazione da ferro e carbonio ci si chiederà perché hanno nomi diversi; ciò dipende dalle proporzioni: nell'acciaio il carbonio è circa l' l% (un po' più o un po' meno è sempre acciaio anche se con caratteristiche un po' diverse) nella ghisa è circa 4% (un po' più o un po' meno) con caratteristiche decisamente diverse dall'acciaio.
SOLUZIONI: sostanza costituita da due o più composti uniti insieme in quantità approssimativamente definite: semplificando molto ma per chiarire la differenza fra la soluzione (che in un certo senso somiglia alla lega) ed il composto facciamo qualche esempio:
vino: acqua e alcole etilico (10% circa)
liquore: acqua ed alcole etilico (35% circa)
Prendendo due bottiglie dello stesso vino o liquore, non possiamo assolutamente garantire che per le stesse molecole di acqua quelle di alcole etilico siano uguali. In una bottiglia infatti ce ne sarà qualcuna in più in un altra qualcuna in meno.
In realtà le leghe e le soluzioni pur entrando a far parte dei miscugli hanno di norma una decisa differenza di fondo vediamo infatti cosa sono i miscugli:
MISCUGLI: possono essere omogenei o eterogenei.
I miscugli omogenei sono tali che ogni parte è uguale ad un'altra e le singole particelle che ne fanno parte non sono visibili al microscopio ottico. vengono detti appunto soluzioni e sono costituite da un solvente e da un soluto (o più soluti). Se uno dei due componenti è liquido esso viene identificato come il solvente: se uno dei due liquidi è l'acqua essa viene considerata solvente. questi sono i più comuni tipi di soluzioni:
Liquido - solido ( esempio acqua e sale o acqua e zucchero)
Liquido - liquido (acqua e alcole, benzina ecc.)
Liquido - gas (acqua e ossigeno, soluzioni di acido cloridrico HCl o ammoniaca NH3)
Solido - solido (raramente formano soluzioni per che di norma guardando al microscopio si vedono strutture diverse. Fanno eccezione le leghe oro argento e poche altre)
Solido - liquido (leghe a base di mercurio Hg usate dai dentisti)
Gas-gas (aria miscuglio omogeneo di azoto N2 78% e ossigeno O2 21%, 1% altri gas fra cui l'Argo Ar 0,9%)
Gas - liquido (aria, sapete che contiene sempre un po' di vapore acqueo al suo interno)
Per dividere i componenti che fanno parte di un miscuglio omogeneo bisogna ricorrere ad operazioni chimico fisiche particolari (spesso sono sufficienti i passaggi di stato)
Miscugli eterogenei. Le singole particelle hanno dimensioni microscopicamente visibili, mantengono inalterate le proprie caratteristiche e si potrebbero dividere con metodi meccanici (calamita, pinzetta ecc.), ma non sempre è così semplice.
Questi sono le strutture micrografiche,
ottenute al microscopio di due
acciai essenzialmente simili in composizione ma che hanno subito
trattamento termici diverso. Si vedono in ogni caso la presenza di
cristalli diversi. La ferrite, chiara è una soluzione di Carbonio in Ferro,
la perlite scura è ancora un miscuglio di sostanze diverse

Come sempre nella chimica tutti concetti sono sfumati. Ci possiamo quindi aspettare dei sistemi a metà fra miscugli omogenei ed eterogenei (soluzioni colloidali) ed altri miscugli particolari quali emulsioni, nebbie, fumi ecc. di cui si parlerà in seguito.
Come abbiamo visto gli elementi sono i "mattoni dell'universo" in quanto dalla loro combinazione sono costituite tutte le sostanze (appartenenti al regno animale, vegetale, minerale) presenti nell'universo. Il numero degli elementi è poco superiore a 100 di cui circa 9° naturali e gli altri ottenuti artificialmente dall'uomo nei laboratori di fisica nucleare. Normalmente le tavole periodiche riportano fino al Laurenzio (n° 103) scoperto nel 1961, ma dopo di lui sono stati sintetizzati altri elementi di scarsissimo interesse chimico in quanto di brevissima vita; questi infatti si decompongono velocemente e le proprietà sono in gran parte sconosciute.
Una prima classificazione degli elementi può essere fatta in base allo stato fisico (di aggregazione ) a temperatura ambiente:
11 elementi sono aeriformi (grigio chiaro nella tabella)
due sono liquidi (grigio scuro nella tabella)
tutti gli altri solidi.
Una seconda classificazione può essere fatta fra gli elementi che dimostrano una caratteristica metallica e quelli che dimostrano una caratteristica non metallica. Questa classificazione , come tante altre presenta limiti ed eccezioni tanto che alcuni autori hanno costituito un gruppo intermedio di elementi detto dei semimetalli. Non essendo tale gruppo sufficiente a comprendere le eccezioni qui ci limitiamo a suddividere gli elementi in metalli e non metalli. Questa distinzione si basa su proprietà e caratteristiche fisiche e chimiche dell'elemento stesso, essendo le proprietà fisiche più intuitive (al nostro stato di conoscenza) ci limitiamo a richiamare queste per fare questa prima tabella di classificazione.
|
metalli |
Non metalli |
|
Solidi eccettuato il Mercurio (Hg) |
Solidi - liquidi- aeriformi |
|
Lucenti (se non ossidati superficialmente) |
Non lucenti. Ma il diamante è carbonio purissimo ed anche lo iodio ha una certa lucentezza |
|
Lavorabili (duttili e malleabili) |
Non lavorabili |
|
Conducono elettricità e calore |
Non conducono elettricità (eccezione la grafite anch'eesa carbonio puro) né calore |
Continueremo la tabella quando avremo imparato anche altre proprietà chimiche degli elementi.
Piuttosto che in ordine alfabetico o altro, gli elementi chimici vengono disposti su una particolare tabella come quella qui sotto riportata in ordine di numero atomico. Nella tabella così disposta per caratteristiche chimiche i metalli in grande maggioranza sono sulla sinistra, i non metalli(eccettuato l'idrogeno H) sulla destra, i semimetalli lungo la spezzata che divide i due gruppi.


|
|
|
I A |
II A |
IIIB |
IVB |
VB |
VIB |
VIIB |
VIII B |
IB |
IIB |
III A |
IV A |
V A |
VI A |
VIIA |
VIIIA |
|||
|
|
H |
Il carattere metallico diminuisce da sinistra a destra nella tavola periodica |
He |
|||||||||||||||||
|
|
Li |
Be4 |
|
B |
C |
N |
O |
F |
Ne10 |
|||||||||||
|
|
Na11 |
Mg |
Al |
Si |
P |
S |
Cl |
Ar 18 |
||||||||||||
|
|
K |
Ca20 |
Sc |
Ti |
V 23 |
Cr |
Mn25 |
Fe |
Co |
Ni |
Cu |
Zn |
Ga |
Ge |
As33 |
Se |
Br |
Kr 36 |
||
|
|
Rb |
Sr |
Y |
Zr |
Nb |
Mo |
Tc |
Ru |
Rh |
Pd 46 |
Ag |
Cd |
In |
Sn |
Sb |
Te |
I |
Xe54 |
||
|
|
Cs |
Ba |
La-Lu |
Hf |
Ta |
W |
Re |
Os |
Ir |
Pt |
Au |
Hg |
Tl |
Pb |
Bi |
Po |
At |
Rn |
||
|
|
Fr |
Ra |
Ac-Lw |
Ku 104 |
Ha 105 |
|
|
| ||||||||||||
Di tutti gli elementi qui riportati ne studieremo 30-40 di cui bisognerà conoscere i nomi e la loro corrispondenza coi simboli.
ABBONDANZA DEGLI ELEMENTI in natura e nel corpo umano
Nella tabella a fianco sono riportate le quantità degli elementi
presenti nella litosfera, la parte di crosta terrestre profonda 16 km e
comprendente l'acqua degli oceano (idrosfera) l'aria(atmosfera) e gli
organismi viventi (biosfera). Si può notare che l'ossigeno da solo costituisce quasi il 50% di
tutta la litosfera e i cinque elementi più abbondanti superano insieme il
90 % della litosfera. Non si sono considerati in queste quantità gli elementi nel nucleo
della terra sia per l'incertezza della composizione sia per la nulla utilità
pratica dal momento che risulta pressoché impossibile estrarre materiale da
più di 16 km di profondità nel sottosuolo. Si
noti l'abbondanza relativa del Titanio rispetto alla scarsità del carbonio
di cui sapete essere fatta la materia vivente, del cloro presente
nell'acqua di mare, dell'azoto nell'aria
|
Elemento |
ppm |
Simboli |
||||||||||||||||||||||||||
|
Ossigeno |
|
O |
||||||||||||||||||||||||||
|
Silicio |
|
Si |
||||||||||||||||||||||||||
|
Alluminio |
|
Al |
||||||||||||||||||||||||||
|
Ferro |
|
Fe |
||||||||||||||||||||||||||
|
calcio |
|
Ca |
||||||||||||||||||||||||||
|
Sodio |
|
Na |
||||||||||||||||||||||||||
|
Potassio |
|
K |
||||||||||||||||||||||||||
|
Magnesio |
|
Mg |
||||||||||||||||||||||||||
|
titanio |
|
Ti |
||||||||||||||||||||||||||
|
Idrogeno |
|
H |
||||||||||||||||||||||||||
|
elemento ossigeno carbonio idrogeno azoto calcio fosforo potassio zolfo sodio cloro totale |
|
P |
||||||||||||||||||||||||||
|
manganese |
|
Mn |
||||||||||||||||||||||||||
|
A destra è riportata l'abbondanza degli
elementi nel corpo umano, dal momento che per il 70 % siamo acqua si
spiega la grande quantità di idrogeno ed ossigeno, complessivamente
comunque, a giudicare dai materiali di base, valiamo . pochi Euro |
|
F |
||||||||||||||||||||||||||
|
zolfo |
|
S |
||||||||||||||||||||||||||
|
stronzio |
|
Sr |
||||||||||||||||||||||||||
|
Bario |
|
Ba |
||||||||||||||||||||||||||
|
Carbonio |
|
C |
||||||||||||||||||||||||||
|
Cloro |
|
Cl |
||||||||||||||||||||||||||
|
azoto |
|
N |
||||||||||||||||||||||||||
|
rame |
|
Cu |
||||||||||||||||||||||||||
|
piombo |
|
Pb |
||||||||||||||||||||||||||
|
argento |
|
Ag |
||||||||||||||||||||||||||
|
totale |
|
|
Tavola periodica di Mendeleev
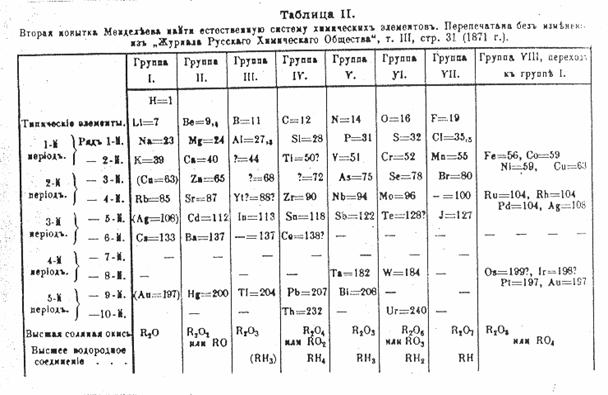
Abbiamo già detto che la disposizione degli elementi nella tavola periodica
moderna del 1961 (che richiama quella di Mendeleev del 1869) dispone a sinistra
i metalli e a destra i non metalli
(eccetto l'idrogeno) in ordine di n° atomico (Mendeleev non lo conosceva ancora
e aveva messo gli elementi in ordine di
peso atomico). Cerchiamo osservando
dall'interno un atomo di capire cos'è il N° atomico e la differenza fra metalli
e non metalli.
L'atomo è una particella costituita a sua volta da tre tipi di particelle: protoni elettroni e neutroni. Essendo piccolissimo non osservabile direttamente neppure col microscopio elettronico, nessuno lo ha mai visto, ma dal 1932 resiste l'ultima teoria che ne ha spiegato la complessa e non facile struttura e le sue caratteristiche come sarà spiegato successivamente (in un prossimo capitolo); in questo momento tali complessità non ci interessano, d'altra parte i chimici del 1800-1900 (da Lavoisier a Proust a Mendeleev ) erano riusciti a capire come erano costituiti i composti e come avvenivano le reazioni, senza neppure conoscere l'esistenza di una delle tre particelle fondamentali che compongono l'atomo.
Ora però, per capire la formazione dei composti ci è conveniente
dare un cenno alla struttura dell'atomo ed ai suoi costituenti. L'atomo è formato da un nucleo in cui si
trovano i nucleoni costituiti
da: protoni di carica elettrica positiva ( 1 ues = 1 unità di
carica elettrostatica, la più piccola carica esistente) massa 1 U.M.A.
circa ( unità di massa atomica oggi chiamata Dalton) neutroni di carica complessivamente neutra e massa anch'essi circa 1 U.M.A. Intorno al nucleo sono presenti gli elettroni di carica elettrica negativa (-1 ues) e massa molto
piccola 1/1836 U.M.A. ( cioè 0,00055
U.M.A).
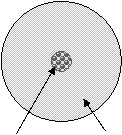
Nucleo Nuvola elettronica
Gli atomi di uno stesso elemento sono caratterizzati dall'avere tutti esattamente lo stesso numero di protoni (1 per H , 2 per l'He,8 per l'ossigeno, 20 per il calcio ecc.) Questo numero corrisponde esattamente al n° d'ordine con cui questi elementi sono indicati sulla tavaola periodica degli elementi ed è detto appunto NUMERO ATOMICO (N.AT.)
In un atomo neutro il numero degli elettroni è uguale al numero dei protoni. Non è però indispensabile avere quel certo numero di elettroni per essere una specie di quell'elemento infatti un atomo può cedere od acquistare uno o più elettroni (diventando ioni: ione positivo o catione o ione negativo o anione). Gli ioni differiscono parecchio dagli atomi neutri, ma è una piccola differenza paragonata a quella di due atomi con un solo protone di differenza.
Ad esempio lo ione Cl- (leggi cloruro) a lo stesso numero di elettroni dello ione K+ (ione potassio) e dell'atomo neutro di Argo, ma si differenziano nel n° di protoni
Il numero di neutroni in un atomo è normalmente uguale o poco maggiore al numero di protoni. Per uno stesso elemento poi possono esistere atomi con diverso numero di neutroni. Questa differenza ha un peso così scarso sulle caratteristiche degli elementi che fu notata solo nel 1912 ( e solo 20 anni dopo attribuita ad un diverso numero di neutroni. E' solo un po' di "colla" in più o in meno che tiene uniti i protoni che essendo carichi positivamente tenderebbero a respingersi.
Nelle tavole periodiche moderne gli elementi sono disposti in ordine di numero atomico, ma questo è stato conosciuto solo ai primi del 1900, precedentemente erano posti in ordine di PESO ATOMICO (P.AT) o meglio massa atomica , noti già nella prima metà del 1800 e, come si vede, utilizzati da Mendeleev per ordinare la sua tavola degli elementi.
Che il peso atomico non fosse un numero intero lo avevano già capito i chimici della prima metà del 1800 (vedere ad es. il Cloro sulla tavola di Mendeleev) anche se potevano supporre qualche errore sperimentale nella misurazione visto che la maggior parte dei pesi atomici risultava multiplo intero del peso dell'idrogeno l'elemento più leggero, posto inizialmente pari ad 1 UMA.
Oggi sappiamo che i numeri atomici non sono numeri interi per vari motivi:
Protone e neutrone non hanno massa 1 bensì leggermente superiore, ed anche l'elettrone ha una piccola massa
Il peso di un atomo formato da più protoni e più neutroni non è ottenuto con la somma aritmetica infatti nella formazione di un atomo c'è la perdita di massa, necessaria a produrre l'energia di legame del nucleo. Questo contributo (di cui si parlerà in un apposito capitolo sulla Chimica nucleare) è però il meno importante.
La massa atomica di un elemento risulta dalla media della massa atomica di tutti gli atomi, qualcuno più leggero, qualcuno più pesante a causa di un diverso numero di neutroni. (questo è il motivo principale)
Due atomi dello stesso elemento che differiscono solo per il numero di neutroni vengono detti isotopi (= stesso posto, sulla tavola periodica ).Gli isotopi sono stati scoperti da Thomson nel 1912. Per 90 elementi stabili oggi si conoscono 283 nuclei stabili (una media di tre a testa ) più un gran numero di isotopi radioattivi ottenuti per lo più artificialmente.
Il numero medio di neutroni in un atomo può comunque essere calcolato facilmente facendo la differenza fra massa atomica e numero atomico infatti pesando in prima approssimazione 1 uma sia il protone che il neutrone ed essendo trascurabile il peso degli elettroni, si può dire che la massa atomica sia la somma del numero dei protoni più quello dei neutroni mentre il numero atomico dà il numero dei protoni pertanto:
N° neutroni = P.AT - N.AT = (N°Protoni + N° Neutroni) - N° Protoni
![]()
Be
Come si può leggere dalla tavola
periodica, molti elementi hanno un peso atomico molto vicino ad un numero
intero (attenti nelle approssimazioni!) o perché non hanno isotopi (Be, F,
Na, Al) o perché uno di questi è in quantità preponderante(oltre il 90%)
rispetto agli altri (H,O, N), ed allora come sappiamo il peso atomico non è
un numero intero, per i motivi 1 e 2 di pagina precedente.
![]() PAT
(arrotondato a 9)
PAT
(arrotondato a 9)
Per altri elementi come il cloro o il magnesio le cose sono più complesse. Vedere sul libro o sugli appunti completi
Premettiamo che le proprietà fisiche e chimiche possono essere di due tipi, intensive (caratteristiche proprie delle sostanze) estensive (che dipendono dalla quantità di sostanza considerata). Solo le proprietà intensive vengono registrate sulla carta d'identità. Se ad esempio parliamo di una persona sarà segnato il colore dei capelli ma non la loro lunghezza. Per le sostanze pure e nel nostro caso gli elementi le caratteristiche intensive sono segnate su una tabella che poi costituisce una casella di quella che viene chiamata la tavola periodica degli elementi.
Come le persone di una stessa famiglia hanno caratteristiche comuni segnate sulla carta d'identità (indirizzo, cittadinanza, cognome), gli elementi chimici vengono raggruppati in famiglie a seconda delle somiglianze chimico-fisiche che queste dimostrano.
Già all'inizio del diciannovesimo secolo Dobereiner aveva raggruppato gli elementi allora conosciuti in triadi. Questa intuizione portò altri chimici ad indagare su altre proprietà ed a ricercare relazioni fra le loro masse atomiche. Meyer studiò il volume atomico diagrammandolo in funzione della massa atomica e ricavò un chiaro andamento periodico tanto da proseguire lo studio diagrammando temperature di fusione, temperature di ebollizione e densità, tutte proprietà intensive. Mendeleev interpretò questi dati e sistemò gli elementi nella sua tabella lasciando degli spazi vuoti corrispondenti al posto degli elementi non ancora scoperti di cui però previde la massa molecolare ed altre proprietà. La conferma in breve tempo delle sue teorie, con la scoperta degli elementi mancanti con le proprietà previste, dettero ampia fama a Mendeleev.
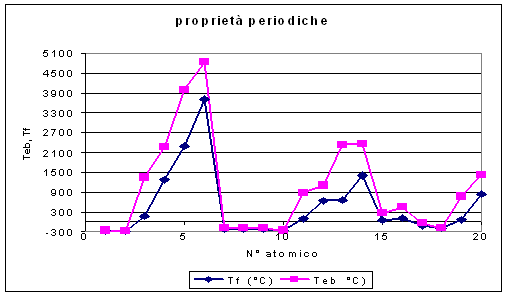
Qui di seguito vengono riportate alcune proprietà intensive da
cui si riesce a capire la periodicità della Teb e Tf in funzione del n° atomico
Da queste periodicità come da quella della densità si sono evidenziate le caratteristiche fisiche degli elementi da cui si può dedurre il motivo della loro sistemazione in famiglie. Ma ancora maggiori delle similitudini fisiche sono le similitudini chimiche degli elementi.
Già nella tavola di Mendeleev vengono evidenziati per ogni famiglia il tipo di composto che gli elementi formano con l'ossigeno e con l'idrogeno. Si noti il rapporto di combinazione costante per tutto il gruppo. Un'altra caratteristica molto importante è il Potenziale di ionizzazione od ENERGIA DI IONIZZAZIONE cioè l'energia che deve essere fornita per estrarre uno o più elettroni dall'atomo neutro. Vedi libro
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2024