|
|
| |
1 - GENERALITA'
La posizione occupata dal carbonio nella tavola periodica, praticamente centrale, gli conferisce caratteristiche del tutto particolari:
avendo 4 elettroni esterni (fig. 1), cioè giusto la metà degli otto dell'ottetto di valenza, il C non ha alcuna tendenza né ad acquistare né a cedere i 4 elettroni, ma propende a condividerli con altri atomi generando legami covalenti;

figura 1
per lo stesso motivo il C possiede la capacità di legarsi ad altri atomi di C con legami covalenti omopolari, e quindi molto stabili, creando agglomerati atomici (fig. 2):
a) lineari C C C C C
C
b) ramificati C C C C
C
c) ciclici

figura 2
la notevole stabilità dei composti organici che risiede nel legame C C omepolare ed anche in quello molto frequente C H scarsamente polare o quasi omepolare (De = 0,4 eV), cui concorre anche il ridottissimo raggio atomico del C.
2 - I LEGAMI NELLE MOLECOLE ORGANICHE
La configurazione elettronica esterna 2s2 p2 consente al C, con la promozione di un e- ad un sottolivello energetico superiore, tre possibilità di diversa ibridazione, in funzione delle diverse condizioni energetiche ambientali e cioè, come previsto dalla teoria di Pauling, gli orbitali s e p possono, all'atto della formazione del legame, mescolarsi fra loro per dar luogo a nuovi orbitali di diversa forma e geometria di quelli originari.
a) Ibridazione tetragonale sp3
Se uno dei due elettroni di valenza dell'orbitale 2s2 viene eccitato fino a portarsi in un orbitale vuoto 2p, avremo quattro elettroni spaiati:
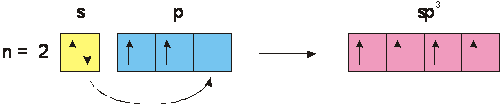
figura 3
In questa situazione i quattro orbitali ibridi acquistano identiche proprietà, diventando isoenergetici, con energia diversa da quelle originarie, come mostrato dalle variazioni di colore della fig. 3.
Per giustificare le identiche proprietà possedute dai quattro orbitali ibridi, si deve presupporre che essi quindi siano isoenergetici ed orientati nello spazio in modo da essere il più possibile distanti reciprocamente per minimizzare la repulsione elettrostatica.
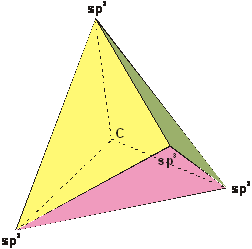
figura 4
Tale
condizione si ottiene, come accade in realtà, se essi si dispongono ai vertici
di un tetraedro regolare con angoli di 109°
2.a) 1 - Legame C C
Se due atomi di C tetragonale si avvicinano in modo che un orbitale sp3 di uno si sovrappone ad un orditale sp3 dell'altro, si forma un legame s covalente omeopolare estremamente stabile perché la nuvola elettronica è equamente condivisa.
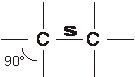
Dopo la formazione del legame resta la disponibilità di altri tre orbitali sp3 liberi per ciascun atomo di C che consentono l'instaurarsi di:
legami s covalenti omopolari con altri atomi di C per formare catene o molecole cicliche
legami s covalenti polari con atomi di H
2.a) 2 - Legame C H
Come appena sopra detto, è un legame covalente polare generato dalla sovrapposizione di un orbitale sp3 del C con l'orbitale s dell'H formando un orbitale asimmetrico essendo l'atomo di C molto più elettronegativo di quello dell'H.
b) Ibridazione trigonale sp2
Quando la variazione di energia riguarda solo tre dei quattro orbitali esterni del C, si
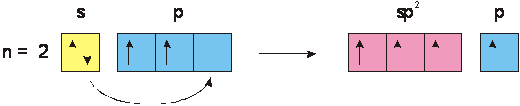
figura 5
ottengono tre orbitali ibridi isoenergetici sp2 giacenti su uno stesso piano a contenente il nucleo dell'atomo e disposti reciprocamente con angoli di 120°, mentre il restante orbitale puro p si dispone su un piano b a per cui se due atomi di C trigonale si avvicinano per traslazione parallela:
un orbitale ibrido sp2 del primo atomo si sovrappone ad un orbitale sp2 del secondo atomo formando un legame s
l'orbitale puro p del primo atomo di C si sovrappone almeno in parte all'orbitale p puro del secondo atomo di C generando un legame p più debole e più corto del precedente.
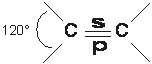
In conclusione si genera un legame doppio che irrigidisce notevolmente la struttura impedendo la libera rotazione dei singoli atomi e lasciando liberi due e- sp2 che vengono impegnati in altri legami C C o C H a formare strutture a catena o ciclica.
c) Ibridazione digonale sp
La variazione di energia riguarda solo due quattro e- esterni del C generando così
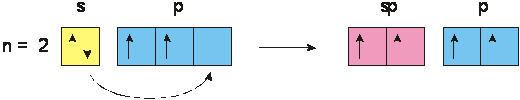
figura 6
due orbitali isoenergetici sp giacenti su uno stesso piano a passante per nucleo dell'atomo e disposti a 180° fra loro e due orbitali puri p giacenti su un piano b a per cui se due atomi di C digonale si avvicinano per traslazione parallela:
un orbitale ibrido sp del primo atomo si sovrappone all'orbitale ibrido sp del secondo atomo formando un legame s
i due orbitali puri p del primo atomo si sovrappongono a quelli del secondo atomo formando due orbitali (o legami) p più corti e più deboli di quello s

In conclusione si genera un legame triplo che lascia libero un elettrone sp per ciascun atomo di carbonio che può utilizzare per legarsi ad altri atomi di carbonio o di idrogeno.
3 -
Fino ad ora nei legami C C, sia di tipo p che s, abbiamo considerato che la coppia di e- che forma il legame sia confinata fra i due nuclei degli atomi ed equamente condivisa. Questa situazione non sempre si verifica, anzi è frequente una delocalizzazione della coppia di e- con conseguenze notevoli sulla stabilità della struttura e sulla reattività della molecola che contiene il legame.
3.a - Effetto induttivo
Nella sequenza
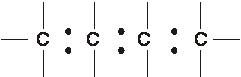
la condivisione elettronica dei legami di tipo s fra due atomi di C contigui, è perfetta. Però se ad un qualsiasi atomo di C va a legarsi un atomo o un gruppo atomico (X) con elettronegatività diversa, la condivisione viene alterata in quanto, vicino all'atomo più elettronegativo, la densità elettronica aumenta polarizzando il legame e questa polarizzazione si trasmette inoltre agli atomi contigui con intensità decrescente, fino ad annullarsi dopo pochi atomi di C.
La trasmissione della polarizzazione prende il nome di effetto induttivo ed interessa solo legami s determinando due possibilità:
a) il sostituendo X è meno elettronegativo del C
C X o anche Cd Xd effetto induttivo +I elettronrepulsivo
a) il sostituendo X è meno elettronegativo del C
C X o anche Cd Xd effetto induttivo -I elettronattrattivo
3.b - Risonanza o mesomeria
Esaminando le molecole di anidride solforica SO3 dovremmo concludere, in accordo con la teoria di Lewis, che essa contiene due legami singoli dativi ed un doppio legame covalente polare.
I dati sperimentali però evidenziano che i tre legami S O hanno tutti la stessa lunghezza, intermedia tra quella di un legame singolo ed un legame doppio, sono complanari e sono disposti a 120° fra loro.
La struttura reale dell'anidride solforica mostra invece che ogni legame S O è per 1/3 doppio e per 2/3 singolo, per cui si ottiene una forma intermedia o mesomera, fra le tre possibili strutture limite fra loro equivalenti, che in essa coesistono.
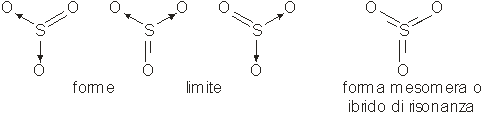
Tutte le forme mesomere, che risultano tanto più stabili quante più forme limite hanno, sono il risultato di fenomeni di delocalizzazione di coppie di elettroni.
4 - ROTTURA E FORMAZIONE DEI LEGAMI COVALENTI
Quasi tutte le reazioni organiche avvengono per rottura e riformazione di legami covalenti che si realizzano per:
a) scissione emolitica di legame in cui ognuno degli atomi contraenti mantiene uno degli elettroni prima condivisi, generando due radicali liberi, ciascuno con un elettrone spaiato
![]()
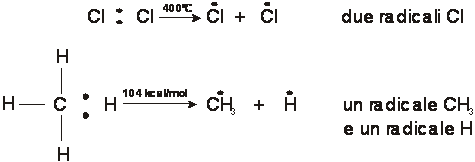
b) scissione eterolitica di legame in cui l'atomo più elettronegativo dei contraenti mantiene i due elettroni prima condivisi, generando due ioni o due siti molecolari a carica opposta

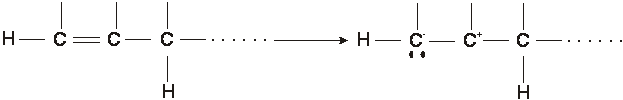
Da quanto detto emerge che esistono tre categorie di reagenti organici:
radicali liberi: sono specie chimiche dotate di un elettrone spaiato ed estremamente reattive
reagenti elettrofili: sono reagenti che hanno una spiccata tendenza per le cariche negative e quindi tendono a ricevere doppietti di elettroni liberi (acidi di Lewis)
reagenti nucleofili: sono reagenti che hanno una spiccata tendenza per le cariche positive e sono dotati di uno o più doppietti di elettroni non condivisi (basi di Lewis)
5 - ISOMERIA
Nei composti inorganici ad ogni formula molecolare corrisponde una e una sola formula di struttura, mentre nei composti organici ad una sola formula molecolare possono corrispondere due o più formule di struttura corrispondenti ciascuna ad una diversa disposizione nello spazio dei legami e dei singoli atomi.
Pertanto si chiamano isomeri due o più composti diversi aventi la stessa formula molecolare ma differente formula di struttura.
Si verificano casi in cui alla diversa formula di struttura corrispondono composti sia dalle diverse proprietà fisiche (punto di ebollizione, di fusione, di congelamento, densità, ecc.), sia proprietà chimiche profondamente diverse come, ad esempio al C4H10O cui corrispondono un alcol ed un etere:
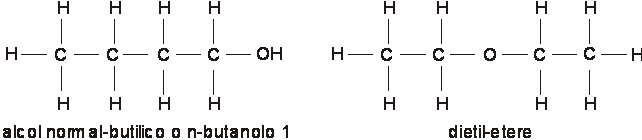
L'isomeria può presentarsi in riferimento alla forma della catena carbonica, alla posizione assunta da un sostituente o da un legame, alla disposizione spaziale degli atomi componenti.
Il
numero di isomeri cui può dar luogo una formula molecolare cresce rapidamente
con il numero di atomi di carbonio in essa contenuti; ad esempio alla formula C4H10
corrispondono 2 isomeri, a quella C9H20 ne corrispondono
5.a) Isomeria di catena
Gli atomi di carbonio di una molecola organica possono concatenarsi in tutte e tre le diverse forme di catene che conosciamo; ad esempio alla formula C4H8 corrispondono i tre isomeri:
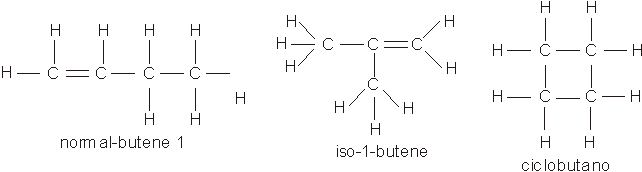
5.b) Isomeria di posizione
Si riferisce alla posizione che un atomo o gruppo di atomi assume in una catena carbonica come ad esempio il gruppo OH nel C3H8O
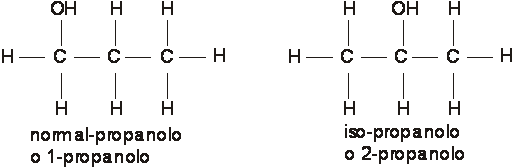
5.c) Isomeria spaziale o stereoisomeria
Si hanno due diversi tipi di stereoisomeria e cioè quella geometrica o cis-trans e quella ottica o enantiomeria.
5.c - 1 - Isomeria spaziale geometrica o cis-trans
L'isomeria geometrica si ha quando nella molecola esistono impedimenti alla libera rotazione di gruppi atomici in essa presenti: infatti nelle molecole tenute insieme da legami singoli (s) come ad esempio ClH2C CH2C, è sempre possibile che ciascun gruppo CH2Cll possa liberamente ruotare intorno al legame (come due girandole unite da un'asticciola) senza in alcun modo modificare e deteriorare la molecola essendo il legame s abbastanza resistente per mantenerne l'integrità e quindi nel contempo impedire la formazione di isomeri geometrici.
Se invece nella molecola è presente un legame doppio (s p) fra due atomi di carbonio, come nella molecola dell'1-2-dicloroetene C2H2Cl2, di struttura ClHC = CHCl, la rotazione intorno al legame è impedita dal legame p che irrigidisce la struttura (le due girandole dell'esempio precedente sarebbero unite da due asticciole che ne bloccano il movimento).
Però in realtà esistono due molecole di dicloroetene con caratteristiche chimico-fisiche diverse per cui si deve ipotizzare l'esistenza di due diverse configurazioni spaziali che costituiscono una coppia di isomeri geometrici:

distinti in isomero cis in cui i due atomi di cloro stanno dalla stessa parte rispetto al piano ideale che contiene il doppio legame, isomero trans quello in cui i due atomi di cloro stanno da parti opposte al suddetto piano.
L'isomeria geometrica si verifica solo nel caso in cui i due atomi di carbonio impegnati nel doppio legame sono entrambi legati ad atomi o gruppi atomici diversi.
Ovviamente la possibilità di isomeri geometrici connessa all'esistenza del doppio legame non vale per le strutture cicliche in quanto, pur esistendo solo legami singoli fra gli atomi di carbonio, la rigidità del piano molecolare impedisce la rotazione e quindi rende possibile l'esistenza di forme cis-trans come, per esempio, nel 1-2 diclorocicloesano
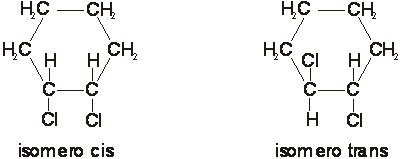
5.c - 2 - Isomeria spaziale ottica o enantiomeria
E' noto che le mani costituiscono due figure non sovrapponibili in quanto sovrapponendole a palmi entrambi rivolti verso il basso o verso l'alto, le dita della mano sinistra non occupano la stessa posizione di quelle della mano destra.
Se invece si pone per esempio la mano destra di fronte ad uno specchio, l'immagine riflessa riproduce esattamente la mano sinistra per cui si conclude che la mano non è sovrapponibile alla sua immagine speculare.
Tutte le strutture che godono di questa proprietà si dicono chinali e la chiralità, molto diffusa in natura, si ritrova anche in numerose strutture molecolari.
In particolare un atomo di carbonio (indicato con un asterisco per convenzione) si dice chinale o asimmetrico quando è legato a quattro atomi o gruppi atomici diversi conferendo alla molecola la proprietà di esistere in due isomeri diversi i quali, pur avendo la stessa formula di struttura, differiscono per la disposizione nello spazio degli atomi o dei gruppi atomi legati al suddetto C*.
Pertanto si definiscono enantiomeri o antipodi ottici gli isomeri ad immagine speculare, tali che le loro strutture spaziali non sono sovrapponibili.
Un atomo di carbonio chinale legato a quattro diversi atomi o gruppi atomici H,X,Y e Z, origina due configurazioni spaziali diverse a immagine speculare dando luogo a due enantiomeri come mostrato in figura 7 ed esemplificato dalla rappresentazione su un piano
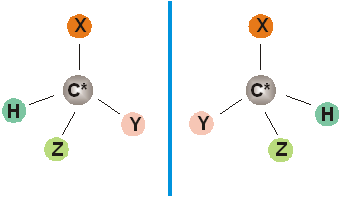
figura 7
di una molecola di gliceraldeide:
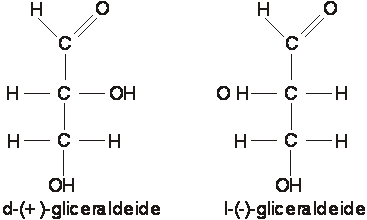
A B
I due enantiomeri hanno le stesse proprietà fisiche con l'unica eccezione di essere il primo destrogiro ed il secondo levogiro a secondo di come fanno deviare verso destra o verso sinistra il piano della luce polarizzata(1).
Tale peculiarità non si riflette sul piano chimico: infatti gli enantiomeri hanno le stesseproprietà chimiche, salvo che nei confronti di reagenti otticamente attivi rispetto ai quali evidenziano diverse velocità di reazione.
Una miscela in parti uguali di due enantiomeri è ovviamente otticamente inattiva e viene detta racemo.
(1) La normale luce solare vibra in infiniti piani tutti perpendicolari alla direzione di propagazione del raggio luminoso; la luce resa polarizzata dall'impiego di speciali lenti vibra invece in uno solo di questi piani detto, per l'appunto, piano di vibrazione della luce polarizzata: quando un raggio di luce polarizzata attraversa una soluzione di sostanza otticamente attiva, allora il piano di vibrazione del raggio emergente risulta ruotato di un certo angolo rispetto al piano di vibrazione del raggio incidente.
Gli enantiomeri sono tutti otticamente attivi e nel caso della glicerladeide, si assiste ad una rotazione verso destra del piano della luce polarizzata se esso attraversa una soluzione contenente la molecola A della figura, verso sinistra se attraversa una soluzione contenente la molecola B.
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2024