|
|
| |
GRUPPI FUNZIONALI
Trattando gli idrocarburi si sono incontrati alcoli, alogenoderivati, aldeidi, acidi, ecc.., cioè i gruppi funzionali. Un gruppo funzionale è un raggruppamento di atomi capace di fornire alla molecola, che lo contiene, un insieme di proprietà caratteristiche. La IUPAC (International Union of Pure and Applied Chemistry) contempla un elenco di gruppi funzionali che è bene guardare con una certa elasticità. Così ad esempio il doppio legame C=C non è considerato un autentico gruppo funzionale, tuttavia rientra nella definizione data: tutte le molecole con doppio legame hanno desinenza -ene, sono preparate in un certo modo, hanno un certo tipo di reattività, sono riconosciute in un certo modo e così via. Qui di seguito sono considerati i principali gruppi funzionali esaminandone nomenclatura, proprietà fisiche, metodi di preparazione e/o reperibilità, reattività e facendo una breve descrizione dei termini più importanti.
Sono composti derivabili da un idrocarburo (di qualunque famiglia) per sostituzione di uno o più atomi di H con atomi di alogeni (F, Cl, Br, I) uguali o diversi tra loro. I nomi sono molto semplici da ricavare. In parentesi è citato il nome di uso comune.
H Cl Cl Cl
| | | |
H - C - Cl H - C - Cl Cl - C - Cl F - C - Cl
| | | |
H Cl Cl F
Clorometano Triclorometano Tetraclorometano Diclorodifluorometano
(cloruro di metile) (cloroformio) (tetracloruro di (freon)
carbonio)
[118] [119] [120] [121]
![]()
![]()
![]()
![]()
![]()
![]() F H H H
F H H H
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() C=C C H
C=C C H
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Br H Cl H
1-fluoro-3-bromo cloroetilene bromuro di benzile
cicloesano
(cloruro di vinile)
[122] [123] [124]
I punti di ebollizione sono superiori a quelli degli alcani con uguale numero di atomi di carbonio e seguono l'ordine I>Br>Cl>F. Sono insolubili in acqua e solubili nei solventi poco polari. Hanno in genere densità >1. Introdotto in un idrocarburo, l'alogeno ne abbassa l'infiammabilità per cui il metano (ottimo combustibile), trasformato in CCl4, viene impiegato come liquido antincendio. Gli alogenoderivati sono tutti caratterizzati da attività biocidi (insetticidi, aggressivi, ecc..). Si sono incontrati finora numerosi esempi di preparazione di alogenoderivati per sostituzione o addizione di idrocarburi. Un altro metodo generale di preparazione parte dagli alcoli per trattamento con acido cloridrico (o alogenidrico in generale HX) in presenza di cloruro di zinco fuso [125].
![]() R- OH + HX ZnCl2 R - X + H2O
R- OH + HX ZnCl2 R - X + H2O
Le reazioni fondamentali degli alogenoderivati sono tre:
1) eliminazione
2) formazione dei reattivi di Grignard
3) sostituzioni nucleofile
Eliminazione: è già stata presa in considerazione nella preparazione degli alcheni [ ].
Formazione dei reattivi di Grignard: facendo reagire un alogenuro alchilico R-X (o arilico Ar-X) con tornitura di magnesio in un solvente apolare anidro si forma un alogenuro di alchilmagnesio [126].
![]() R - X + Mg R - Mg -
X R Mg - X
R - X + Mg R - Mg -
X R Mg - X
[126] [127]
Questo a causa della bassa elettronegatività del magnesio, diventa comoda fonte di gruppi R: [127], utilissimi nelle sintesi organiche. L' ambiente anidro è necessario perché i reattivi di Grignard vengono rapidamente decomposti dall'acqua in alcani [128].
![]() R - Mg - X + H -
OH R - H + Mg(OH)X
R - Mg - X + H -
OH R - H + Mg(OH)X
Sostituzioni nucleofile: costituiscono un gruppo di reazioni di uso frequentissimo in chimica organica. Nell'alogenuro alchilico polarizzato nel senso indicato [129], il carbonio costituisce un centro di attacco che parte dei reattivi nucleofili (anioni o basi di Lewis) che ad esso si legano, sostituendo l'alogeno che funge da gruppo uscente (X-).
![]()
d d
![]() R - X + OH R - OH + X−
R - X + OH R - OH + X−
Nell'esempio riportato si forma un alcol, ma l'elenco dei reattivi che danno sostituzione nucleofila (abbreviazione SN) è molto ampio (R - O− , R−CO−O , CN−, SH−, NH2−, R - C C−, ecc.).
Si tenga presente che l'alogeno è molto reattivo se legato ai gruppi saturi. Quando è legato a gruppi insaturi (es. cloruro di vinile) o aromatici ( es. clorobenzene) diventa particolarmente inerte alle SN.
CLORURO DI METILE (CH3Cl) [118]: gas incolore, velenoso, liquefacibile per compressione, usato come metilante (introduzione del gruppo CH3) e nell'industria frigorifera.
CLOROFORMIO (CHCl3) [119]: liquido insolubile in acqua, punto di ebollizione 62°C, usato come solvente.
CLORURO DI VINILE (CH2=CHCl) [123]:gas incolore, facilmente liquefacibile, usato nella preparazione di materie plastiche (PVC).
TRIELINA (CHCl=CCl2) [130] : liquido insolubile in acqua, punto di ebollizione 87°C, usato come solvente e smacchiatore di oli, grassi, cere, resine, vernici, gomme.
TETRAFLUOROETILENE (CF2=CF2) [131]: prodotto di partenza per la preparazione del teflon (PTFE, caratterizzato da inerzia chimica e fisica; autolubrificante), importantissimo polimero sintetico.
DDT [1,1,1-tricloro-2,2-bis (p-clorofenil )-etano ] [132]
Cl
|
Cl - C - Cl

 |
|
![]()
![]() Cl C Cl
Cl C Cl
|
H
Nitro derivati
Sono normalmente derivabili da un qualunque idrocarburo per sostituzione di uno o più atomi di idrogeno con il nitrogruppo - NO2 (- N =O ).
↓
O
Il loro nome viene formato usando il prefisso nitro-:
CH3−NO2 Nitrometano
NO2

![]()
![]() 2-nitronaftalene o
2-nitronaftalene o
β-nitronaftalene
NO2
|
![]()
m-dinitrobenzene
![]()
NO2
Sono generalmente colorati in giallo ed hanno più o meno marcato carattere esplosivo. I derivati aromatici sono di gran lunga più importanti di quelli alifatici. Si preparano per nitrazione (sostituzione elettrofila aromatica). Essendo prodotti altamente ossidati, le loro reazioni caratteristiche saranno di riduzione. Accanto ai nitroderivati si ricordano i nitrosoderivati che si ricollegano all'acido nitroso e sono caratterizzati dal nitrosogruppo - NO (−N=O)
Nitrobenzene (C6H5NO2) [ ]: liquido giallo, punto di ebollizione 211°C, velenoso, dall'odore di mandorle amare.
Tritolo (2,4,6-trinitrotoluene) [ ]
Sono composti caratterizzati dal gruppo funzionale - OH.. Ci sono alcoli saturi, insaturi, ciclici, aromatici, primari, secondari, terziari (secondo che l'OH sia legato ad un carbonio primario, secondario, terziario); monovalenti, bivalenti, polivalenti (se contengono uno, due o più ossidrili). I fenoli sono gli alcoli in cui l'OH è legato al carbonio di un anello aromatico.
La desinenza ufficiale della funzione - OH è - olo. La numerazione delle catene è fatta in modo da attribuire all'OH (o agli -OH ) i numeri più piccoli possibili.
Vi sono anche nomi d'uso comune conservati (indicati in parentesi). In casi complessi il gruppo - OH viene chiamato idrossi.
H H H H OH H
| | | | | |
H− C−OH H−C−C− OH H−C− C − C−H
| | | | | |
H H H H H H
(alcol metilico) (alcol etilico) (alcol isopropilico)
alcol primario monovalente saturo alcol primario monovalente saturo alcol secondario monovalente saturo
[137] [138]
OH OH OH OH
| | | |
 H− C − C − C −H
H− C − C − C −H
| | |
H H H CH2=CH - CH2OH
1,2,3 PROPANTRIOLO CICLOESANOLO 2-PROPEN-1-OLO
(glicerina) (alcol allilico)
alcol primario 2 volte, secondario alcol secondario monovalente alcol primario monovalente
1 volta, trivalente, saturo ciclico insaturo.
FENOLO C6H5OH [142]: alcol secondario, monovalente, aromatico.
DI-DROSSIBENZENI (o-, m-, p-) [143]: alcoli secondari, bivalenti, aromatici.
OH

 |
|
 OH
OH
![]()
![]()
![]() [143]
[143]
OH
![]() La
presenza dell'ossidrile conferisce agli alcoli la possibilità di formare legami
idrogeno intermolecolari (R - O H - O - R ) che ne innalzano il
punto di ebollizione rispetto agli idrocarburi a pari atomi
La
presenza dell'ossidrile conferisce agli alcoli la possibilità di formare legami
idrogeno intermolecolari (R - O H - O - R ) che ne innalzano il
punto di ebollizione rispetto agli idrocarburi a pari atomi
| H
H │
![]() di
carbonio, e legami idrogeno con l'acqua (R - O H - O - H ) che ne aumenta la
solubilità in tale solvente.
di
carbonio, e legami idrogeno con l'acqua (R - O H - O - H ) che ne aumenta la
solubilità in tale solvente.
Si sono già incontrati alcuni metodi di preparazione degli alcoli: idratazione degli alcheni[ ], ossidrilazione degli alcheni con permanganato[ ], idrolisi degli alogenuri (SN, [ ]). Un altro metodo generale per ottenere gli alcoli, in particolare quello etilico, consiste nella fermentazione di zuccheri da parte di microrganismi (saccaromiceti). La preparazione dei fenoli ricorre alla fusione alcalina degli acidi solfonici:
SO3H OH
![]()

![]()

![]()
![]() KOH
KOH
![]() + K2 SO3
+ K2 SO3
![]() 300°C
300°C
ACIDO BENZENSOLFONICO FENOLO SOLFITO DI
POTASSIO
[ ] [142]
Le reazioni degli alcoli si distinguono a seconda del legame che viene rotto :
![]()
![]()
![]()
![]() R OH oppure RO H
R OH oppure RO H
Tra le prime si ricordano la DISIDRATAZIONE che porta alla formazione di alcheni [ ]e la trasformazione in alogenuri alchilici [125].
Tra le seconde:
Carattere acido base: gli alcoli grazie alla loro stretta somiglianza con l'acqua (R - O - H, H - O - H ), hanno comportamento anfotero, cioè vengono protonati [143] dagli acidi forti (comportamento basico) e salificati dalle basi forti (comportamento acido).
![]() R - O - H + H+ R - O + - H
R - O - H + H+ R - O + - H
|
H
![]() R - O - H + Na R - O−
Na + + ½ H2
R - O - H + Na R - O−
Na + + ½ H2
I loro sali sono chiamati alcolati [144] e vengono facilmente idrolizzati dall'acqua, trattandosi di sali di acido debole e base forte (come acido un alcol ha una Ka 10-16). I sali dei fenoli sono invece stabili in soluzione acquosa, avendo i fenoli una Ka
Ossidoriduzione: gli alcoli sono da considerarsi come gruppi relativamente ridotti, per cui si prestano a reazioni di ossidazione (deidrogenazioni) che trasformano gli alcoli primari in aldeidi [145] e quelli secondari in chetoni[146]. Gli alcoli terziari in generale danno prodotti di ossidazione nei quali si è persa l'identità dello scheletro dell'alcol di partenza.
H H
| |

 R - C - O R - C = O
R - C - O R - C = O
| | ALDEIDE
H + K2Cr2C7 H

- H2
H H
| |
R - C - O R - C = O CHETONE
| |
R' R'
Formazione di eteri: per disidratazione di alcoli si ottengono i corrispondenti eteri [147].
- H2O
![]() R - O -
H + H - O - R R - O - R
R - O -
H + H - O - R R - O - R
Si noti che già si è detto che la disidratazione di alcoli porta ad alcheni [ ]. Le due cose non sono contrastanti in quanto la disidratazione di un alcol può essere sia intramolecolare [ ] che intermolecolare [147], a seconda delle condizioni sperimentali in cui la reazione viene condotta e, per bene che vadano le cose, si ottengono sempre o alcheni contaminati da eteri o eteri contaminati da alcheni.
Formazione di esteri: per disidratazione intermolecolare tra un acido e un alcol si formano esteri [148].
O O
|| ||
![]() R - O - H + H
- O - C - R R - O - C
- R
R - O - H + H
- O - C - R R - O - C
- R
- H2O
![]()
![]() Alcool metilico CH3OH [136]: liquido
infiammabile, punto di ebollizione 65°C, molto velenoso. Si ottiene
industrialmente per sintesi da ossido di carbonio e idrogeno ( CO +2H2
CH3OH).
Alcool metilico CH3OH [136]: liquido
infiammabile, punto di ebollizione 65°C, molto velenoso. Si ottiene
industrialmente per sintesi da ossido di carbonio e idrogeno ( CO +2H2
CH3OH).
Alcool etilico CH3CH2OH [137]: liquido infiammabile, punto di ebollizione 78,5°C. Quello destinato ad uso alimentare è al 95%; è possibile ottenere alcol al 100%, chiamato assoluto. Per uso non alimentare viene denaturato per aggiunta di metanolo, toluene, sostanze maleodoranti e coloranti, godendo in tal modo di particolari sgravi fiscali.
Glicole etilenico CH2OHCH2OH oppure CH2−- CH2 [ ]
| |
OH OH
Liquido solubilissimo in acqua, punto di ebollizione 197°C, usato come anticongelante e, sotto forma di etere nitrico, come esplosivo.
Fenolo C6H5OH [142]: solido, punto di fusione 43°C, poco solubile in acqua, velenoso e caustico. È usato come disinfettante e per produrre materie plastiche, concianti, coloranti, esplosivi e prodotti farmaceutici.
Glicerina CH2OH−CHOH−CH2OH oppure CH2 - CH - CH2 [ ] :
| | |
OH OH OH
Liquido oleoso solubilissimo in acqua, punto di ebollizione 290°C, di sapore dolciastro, di cui sono noti oltre 1500 impieghi (solvente, plastificante, emolliente, in profumeria e cosmesi, nella stampa, come antigelo, per produrre la nitroglicerina).
Cresoli [149]:

OH

![]()
CH3
sono i tre metilfenoli isomeri (orto, meta, para). Si trovano nel catrame e sono velenosi. Sono disinfettanti energici e costituiscono materia prima per fare coloranti , profumi, esplosivi.
Come si è già visto [147] sono composti di formula generale R - O - R , R - O - Ar, Ar -O - Ar , riconducibili ai prodotti della disidratazione intermolecolare alcol - alcol (R - O - R ) , alcol - fenolo (R - O - Ar), fenolo - fenolo (Ar -O - Ar ). Nel caso in cui R = R si parla di eteri semplici o simmetrici, nel caso in cui R R si parla di eteri misti o asimmetrici. Ci sono anche eteri ciclici riconducibili a disidratazione intramolecolare.
CH3 − O − CH3 ETERE DIMETILICO
CH3 − CH2 − O − CH2 − CH3 ETERE DIETILICO
![]()
![]() CH2 − CH2
CH2 − CH2
O O DIOSSANO
![]()
![]()
CH2 − CH2

![]()
![]()
![]() O CH3 METIL-FENIL-ETERE
O CH3 METIL-FENIL-ETERE
L'angolo C-O-C negli eteri ciclici si aggira intorno ai 110°. Non sono legati da legami di idrogeno intermolecolari, per cui bollono a temperature più vicine a quelle dei corrispondenti idrocarburi, che non dei corrispondenti alcoli. Formano legami H con l'acqua in cui termini inferiori (cioè le molecole più piccole) e soprattutto quelli ciclici, manifestano una discreta solubilità.
La preparazione dei termini aciclici è la seguente:
A)disidratazione degli alcoli[147].
B) sostituzione nucleofila in alogenuri alchilici con gruppi R - O― [ ]: rientra in uno degli esempi della suddetta reazione quello in cui si usa, come reattivo nucleofilo, uno ione alcolato (ione che deriva dall'alcool)[144]. La reazione è nota come SINTESI DI WILLIAMSON.
Gli eteri sono basi deboli di Lewis, grazie al doppietto dell'ossigeno, e vengono protonati da acidi forti.
H
|
R - O+ - R ETERE PROTONATO
Il legame C - O - C è poco reattivo, quasi si trattasse di un legame C - C - C. L'unico reattivo che scinde il legame etereo è l'acido iodidrico che trasforma gli eteri in ioduri alchilici [154].
![]() R - O - R + 2
HI 2 R - I + H2O [154]
R - O - R + 2
HI 2 R - I + H2O [154]
Caratteristiche di alcuni composti :
![]()
![]()
O
ottiene dall'etilene per trattamento con ossigeno in presenza di catalizzatori (ossidazione catalitica). In ambiente acido addiziona acqua per dare glicole etilenico [ ] oppure dimerizza (raddoppia la molecola) a diossano [152], liquido molto usato come solvente.
![]()
![]() Il gruppo carbonilico C = O è presente in molti gruppi funzionali contenenti ossigeno, tuttavia
Il gruppo carbonilico C = O è presente in molti gruppi funzionali contenenti ossigeno, tuttavia
![]()
![]() H R
H R
![]()
![]() i composti carbonilici per eccellenza sono le aldeidi C = O ed i chetoni C = O.
i composti carbonilici per eccellenza sono le aldeidi C = O ed i chetoni C = O.
H R
La struttura del gruppo carbonilico [156] è planare, il carbonio ha ibridizzazione sp2 e il legame
![]() d d
d d
C = O risulta polarizzato nel senso C == O (C = O); la sua energia è di 180 kcal/mole e la lunghezza è di 1,21Å. Trattandosi di molecole polari, legate da interazioni di dipolo e non da legami di idrogeno (che avrebbero maggiore energia), bolliranno a temperatura più alta rispetto ad idrocarburi ed eteri di analogo peso molecolare e più bassa rispetto ai corrispondenti alcoli. Potendo
σ
![]()
![]() π
π
![]() 120° C = O
120° C = O
σ
σ
formare legami di idrogeno con l'acqua, sono in essa solubili fino a C4 - C5. Molte aldeidi hanno profumo gradevole.
Aldeidi
Il gruppo aldeidico si trova in posizione terminale (il C aldeidico ha una sola valenza libera) e gli spetta il numero 1. La desinenza ufficiale è - ale , ma sono molto diffusi i nomi di uso comune. Esempi (il nome ufficiale è tra parentesi):
H
|
H - C = O FORMALDEIDE (Metanale)
H H
| |
H - C - C = O [ ] ACETALDEIDE (Etanale)
|
H
H H H H
| | | |
C = C - C - C = O 3 - BUTANALE
| |
H H
H
|
![]() C = O
C = O
BENZALDEIDE
Si sono già incontrati alcuni metodi di preparazione delle aldeidi.
Ozonizzazione degli alcheni [ ];
Addizione di H2O agli alchini [ ];
Deidrogenazione degli alcoli primari [145]
Poiché le aldeidi rappresentano uno stadio intermedio di ossidazione fra alcoli e acidi, le si può ottenere per riduzione controllata degli acidi o dei loro derivati usando come riducente idruro di litio e alluminio ( LiAlH4).
OH H
| |
![]() R - C =
O + H2 R -
C = O + H2O
R - C =
O + H2 R -
C = O + H2O
Chetoni
Il gruppo chetonico si trova in posizione non terminale (il C chetonico ha 2 valenze libere) per cui gli spetta il numero più basso possibile (che non è mai il numero 1). La desinenza ufficiale è - one, ma è molto usata la nomenclatura corrente (in parentesi).
H O H O
| || | ||
H - C - C - C - H CH3 - CH2- CH2 - C - CH3
| |
H H
Propanone (dimetilchetone o acetone) 2 - pentanone (metilpropilchetone)
O
![]()
 ||
||
![]() C - CH3
C - CH3
Metilfenilchetone
I due metodi di preparazione sono già stati citati:
Deidrogenazione degli alcoli secondari [146]
Acilazione di Friedel e Crafts [ ].
![]()
![]()
![]()
![]()
![]()
![]()
![]() C =
O C+
─ O−
C =
O C+
─ O−
Data la risonanza che vede, in una forma, il C positivo, le reazioni di aldeidi e chetoni consistono in un'addizione al C da parte di reattivi nucleofili (la parte positiva del reattivo si legherà all'O−). In tutti i casi descritti si faranno esempi relativi ad aldeidi ferma restando la loro validità anche per i chetoni.
![]() (R -
CHO R - COOH) ed è
sufficiente, a compierla, l'ossigeno dell'aria o l'azione di blandi ossidanti
verso cui le aldeidi manifestano proprietà riducenti. Fra questi si ricordano
gli ioni Cu++ che vengono ridotti a Cu+ (reattivo di
Fehling in cui si forma un precipitato di Cu2O, rosso mattone).
L'ossidazione dei chetoni è difficile e gli acidi ottenuti in condizioni
drastiche non hanno più lo scheletro del prodotto di partenza, sono cioè
prodotti di degradazione.
(R -
CHO R - COOH) ed è
sufficiente, a compierla, l'ossigeno dell'aria o l'azione di blandi ossidanti
verso cui le aldeidi manifestano proprietà riducenti. Fra questi si ricordano
gli ioni Cu++ che vengono ridotti a Cu+ (reattivo di
Fehling in cui si forma un precipitato di Cu2O, rosso mattone).
L'ossidazione dei chetoni è difficile e gli acidi ottenuti in condizioni
drastiche non hanno più lo scheletro del prodotto di partenza, sono cioè
prodotti di degradazione.
H OH
![]() | |
| |
![]()
![]()
![]() R - C = O + H OH R - C - OH
R - C = O + H OH R - C - OH
|
H
O - R
![]() |
|
![]() R - C=O + H OR R - C - OH
R - C=O + H OR R - C - OH
| |
H H
OR OR
![]()
![]()
![]()
![]()
![]() | |
| |
![]()
![]()
![]()
![]() R - C−OH + H - OR R - C - OR + H2O
R - C−OH + H - OR R - C - OR + H2O
![]()
![]()
![]()
![]() | |
| |
H H
Addizione di ammoniaca( o suoi derivati): la reazione procede attraverso la formazione di un prodotto di addizione instabile che, spontaneamente, si disidrata in aldimmina [168] (o chetimmina nel caso dei chetoni). Il gruppo −C = N - è chiamato azometinico e questa famiglia |
composti è caratterizzata dal nome generale di BASI DI SCHIFF.
H
|
![]()
![]()
![]()
![]() N- H
N- H
![]()
![]()
![]()
![]()
![]() |
|
![]()
![]()
![]() R - C = O + H NH2 R - C - OH R - C = N
- H
R - C = O + H NH2 R - C - OH R - C = N
- H
![]()
![]()
![]()
![]() | | -H2O
| | -H2O
H H H
[167] [168]
CHO CH2OH COOH
| | |



+H2O
![]()
[159] [169] [170]
Sono i composti caratterizzati dalla presenza del carbossile - COOH [172] funzione altamente ossidata di struttura simile al gruppo carbonilico [156].
![]()
![]() p O
p O
s
![]() R C 120°
R C 120°
![]() σ
σ
s O - H
Gli acidi sono polari e capaci di formare legami idrogeno intermolecolari per cui presentano punti di ebollizione superiori a quelli dei corrispondenti alcoli. Sono solubili in H2O fino a C4 - C5 e nelle basi forti da cui vengono trasformati in sali (R - COO− Na+). I termini inferiori sono liquidi di odore pungente, quelli a C4 - C6 liquidi di odore sgradevole, quelli superiori sono solidi e pressoché inodori. Per l'attribuzione dei nomi si fa largo impiego del nome di uso comune conservato. I nomi ufficiali (tra parentesi) usano la desinenza -oico e, nei casi complessi, la parola acido.carbossilico.
ESEMPI:
OH H OH
| | |
H - C = O Acido formico H - C - C = O Acido acetico
(acido metanoico) | (acido etanoico)
H
![]()
![]() COOH Acido
ciclopropancarbossilico
COOH Acido
ciclopropancarbossilico
COOH
|
![]()

 COOH
COOH
![]()
![]()
![]() Acido benzoico acidi ftalici
Acido benzoico acidi ftalici
(acido orto, meta
COOH para, benzen-
dicarbossilico)
[170] [176]
Nei sali degli acidi si converte la desinenza - ico in - ato di . (es. formiato di calcio, acetato di sodio, benzoato di potassio.). La preparazione degli acidi si realizza in tre modi fondamentali:
Ossidazione: si è già avuto modo di vedere che gli acidi, come composti altamente ossidati, sono prodotti finali di gran parte dei processi ossidativi (ossidazione di aldeidi e chetoni [170]). Si impiegano come ossidanti sia reattivi chimici, sia ossigeno + catalizzatori, sia microrganismi.
Idrolisi dei derivati funzionali degli acidi carbossilici: (prossimo paragrafo).
Carbonatazione dei reattivi di Grignard: è una reazione con cui si introduce il C carbossilico grazie all'impiego di anidride carbonica (O=C=O). Si sono già incontrati i reattivi di Grignard a proposito degli alogeno derivati [126].
O O - MgX OH
![]() || || |
|| || |
![]()
![]()
![]() O = C + R Mg X O = C - R O = C - R + MgX2
O = C + R Mg X O = C - R O = C - R + MgX2
HX
[ ] [177]
La parte negativa (R) del reattivo di Grignard attacca il carbonio, quella positiva (MgX) l' ossigeno; l' intermedio che si forma [177], per trattamento con acido alogenidrico, mette in libertà l'acido carbossilico.
Si esaminino ora le principali reazioni degli acidi:
1.carattere acido: l'acidità di questi composti è legata alla tendenza a dissociarsi secondo l'equilibrio [178] a cui corrisponde una costante (Ka) [179] il cui valore mediamente si aggira intorno a 10-5. Si tratterà pertanto di acidi deboli se confrontati con gli acidi minerali forti.
![]()
![]() R - COOH R - COO + H+
R - COOH R - COO + H+
[R - COO ] [ H+]
![]() Ka = [179]
Ka = [179]
[ R - COOH ]
2. ossidazione: trattandosi di funzione altamente ossidata, è ovvio che l'ossidazione degli acidi non abbia importanza e conduca, se drastica, solo a prodotti degradati. Più importante è la loro riduzione (parziale ad aldeidi o spinta ad alcoli) effettuata con idruri.
3.decarbossilazione: in alcuni casi per semplice riscaldamento, in altri per trattamento con calce sodata (miscela NaOH/CaO ), si ha perdita di CO2 e formazione dell'idrocarburo con un carbonio in meno (acido acetico → metano; acido benzoico → benzene).
4.formazione di derivati funzionali: si è già trattata la formazione di esteri [148] e l'impiego di alogenuri acilici [ ]. L'argomento è così importante che merita la trattazione in un paragrafo specifico.
Esempi di acidi:
Acido formico (HCOOH) [173]: liquido, punto di ebollizione 100°C, caustico, solubile in acqua. Si trova nelle formiche e nelle ortiche. Se ne ottiene il sale sodico per reazione fra soda caustica e ossido di carbonio (CO + NaOH → HCOONa ). Ha proprietà riducenti.
Acido acetico (CH3COOH) [174]: liquido, punto di ebollizione 118°C, irritante, solubile in acqua. È presente nell'aceto e nei prodotti di distillazione secca del legno. Usato come solvente, come acetilante, come conservante alimentare.
Acido benzoico (C6H5COOH) [170]:solido, punto di fusione 122°C, insolubile in acqua. Si prepara per ossidazione del toluene. Ha proprietà antisettiche.
I
D
R alcoli primari aldeidi acidi
O CO2
C
A alcoli secondari chetoni +
R ossidazione [ O
![]() B H2O
B H2O
![]() U alcoli terziari
U alcoli terziari
R riduzione [ H ]
I
Le aldeidi si ottengono o per ossidazione degli alcoli primari o per riduzione di acidi. L'ossidazione può spingersi fino a CO2 (combustione) mentre la riduzione può arrivare fino agli idrocarburi.
Derivati funzionali degli acidi carbossilici
![]()
![]() O
O
![]() Con
questo termine si intendono i composti riconducibili alla formula generale R -
C cioè acidi
Con
questo termine si intendono i composti riconducibili alla formula generale R -
C cioè acidi
Z
in cui l'OH è stato rimpiazzato da un gruppo Z:
![]() O
O
![]()
![]() R C O Anidridi
R C O Anidridi
![]() ║
║
O ── C ── R
![]() O
O
![]()
![]() R C Ammidi
R C Ammidi
![]()
NH2
![]() O
O
![]()
![]() R C Esteri
R C Esteri
![]()
O -- R'
![]() O
O
![]()
![]() R C Alogenuri
R C Alogenuri
![]()
X
Gli alogenuri degli acidi [182], chiamati anche alogenuri di acile (o acilici), vengono denominati con il termine generale alogenuri di ...., seguito da quello dell'acido in cui si è convertita la desinenza - ico in - ile.
![]() H O
H O
![]() │
│
H - C - C Cloruro di acetile
![]() │
│
H Cl
O
C - Br

![]()
![]()
[184] Bromuro di benzoile
Si preparano trattando gli acidi con reattivi capaci di sostituire l'OH con l'alogeno: SOCl2 (cloruro di tionile), PCl3 (tricloruro di fosforo), PBr5 (pentabromuro di fosforo). L'alogeno è molto reattivo e pertanto viene facilmente sostituito da altri gruppi entranti:
O
![]()
![]()
![]() + H - OH
+ H - OH
![]()
![]() R C +HX
R C +HX
[172] O - H
O
![]()
![]()
![]() + H - NH2
+ H - NH2
![]()
![]() R C +HX
R C +HX
![]()
![]() O [181] NH2
O [181] NH2
 R - C
R - C
![]()
X
O
![]()
![]() + R - COO− Na+ + NaX
+ R - COO− Na+ + NaX
![]()
![]()
![]() R C O
R C O
||
[180] O − C −R
O
+ R - O - H
![]()
![]()
![]()
![]()
![]() R C + HX
R C + HX
[148] O - R
O
║
Con queste reazioni si ha sempre l'introduzione di un gruppo acilico R − C − per cui si dice che sono dei reattivi acilanti. I prodotti che si ottengono sono i corrispondenti acidi (idrolisi) o gli altri derivati degli acidi. Si riveda inoltre l'acilazione degli aromatici secondo Friedel e Crafts
[ ].
Le anidridi si possono considerare come i derivanti dagli acidi per disidratazione intermolecolare:
O O O O
|| || || ||
![]()
![]() R - C - O−H + HO
- C - R R - C - O - C - R' + H2O
R - C - O−H + HO
- C - R R - C - O - C - R' + H2O
Possono essere semplici (R=R ) o miste (R R ) ed il loro nome si ricava semplicemente ricorrendo alla parola anidride seguita dal nome dell'acido al femminile: anidride acetica, anidride benzoica, ecc. Si preparano per disidratazione degli acidi con P2O5 (anidride fosforica) o con la reazione [180]. La loro reattività ricalca quella degli alogenuri, salvo due differenze: invece di X il gruppo uscente è
− O − CO − R' e la reattività è più attenuata (acilanti meno energici).
Le ammidi degli acidi si possono considerare come gli acilderivati dell'ammoniaca [181] ed il loro nome si forma utilizzando la radice dell'acido seguito dalla parola ammide: formammide, acetammide, benzammide. Si preparano trattando con ammoniaca i cloruri degli acidi o le anidridi. Per idrolisi si trasformano nei corrispondenti acidi.
Gli esteri derivano dalla disidratazione intermolecolare fra un acido e un alcol [148]. Il loro nome risente di questa derivazione: radice dell'acido seguita da - ato di... -ile.
![]()
![]() H O
H O
![]()
![]() H - C - C H Acetato di metile
H - C - C H Acetato di metile
![]() |
|
H O - C - H
O H H
|| | |
C - O - C - C - H Benzoato di etile
 | | |
| | |
H H
![]()
Si dice anche correntemente: estere metilico dell'acido acetico, estere etilico dell'acido benzoico. La loro reazione di preparazione (ESTERIFICAZIONE) è limitata dalla reazione inversa (idrolisi).
ESTERIFICAZIONE
![]()
![]() R - COOH + R -
OH R
- COO - R + H2O
R - COOH + R -
OH R
- COO - R + H2O
IDROLISI
L'esterificazione è catalizzata da piccole quantità di acidi minerali, l'idrolisi dalle basi: ovviamente i prodotti di idrolisi di un estere, in presenza di NaOH, saranno alcol e sali di sodio dell'acido ( R - COO− Na+). Di tutti i derivati degli acidi, gli esteri sono i più importanti e tra gli esteri hanno particolare rilevanza i grassi. Anche se non rientrano nella formula generale R - CO − Z, si citano i nitrili degli acidi che si ottengono per disidratazione delle ammidi o per sostituzione nucleofila con cianuri. Per idrolisi danno i corrispondenti acidi:
C N
 |
|
H
![]() |
|
H - C - C N Acetonitrile Benzonitrile
|
H
[188] [189]
QUADRO RIASSUNTIVO:
![]() ALCOL + ALCOL ETERE + H2O
ALCOL + ALCOL ETERE + H2O
![]() ACIDO + ACIDO ANIDRIDE +H2O
ACIDO + ACIDO ANIDRIDE +H2O
![]() ACIDO + ALCOL ESTERE + H2O
ACIDO + ALCOL ESTERE + H2O
Ammine
Costituiscono il più importante gruppo funzionale contenente azoto (− NH2). Formalmente si possono considerare come derivanti dall'ammoniaca per sostituzione degli idrogeni con gruppi alchilici e/o arilici.
![]()
![]()
![]() H R R
H R R
![]()
![]()
![]() R - N R - N R - N
R - N R - N R - N
H H R
Ammine primarie Ammine secondarie Ammine terziarie
[190] [191] [192]
![]()
![]()
![]() R R' H H
R R' H H
|
![]()
![]()
![]() N X− H - C - N
N X− H - C - N
R''' R'' H H
Sali di ammonio quaternari Metilammina
[194]
H H H H H H
![]()
![]() | | | |
| | | |
![]()
![]() H - C - C - C - N H - C - N H
H - C - C - C - N H - C - N H
![]() | | | |
| | | |
![]()
![]() H H H H H C
H H H H H C
H H
Propilammina Dimetilammina
[195] [196]
![]()
![]()
![]() CH3 H5C2 C2 H5
CH3 H5C2 C2 H5
H3C - N C I−
![]()
![]()
![]()
C2 H5 H5C2 C2 H5
Dimetil-etilammina Ioduro di tetraetilammonio
[197] [198]
NH2 NH2
![]()
![]()

[199] [200]
Cicloesilammina Anilina
![]() Nei casi complessi il gruppo NH2 viene chiamato ammino. Formano legami di
idrogeno intermolecolari (N - - - - H N ) che conferiscono punti di ebollizione abbastanza elevati inferiori
però a quelli dei corrispondenti alcoli in cui il legame di idrogeno (O - - - -
- H - O ) ha maggiore energia. Si sciolgono in acqua fino a C6. I
sali ammonici hanno le caratteristiche di composti ionici, cioè alto punto di
fusione e buona solubilità in acqua. Le ammine alifatiche inferiori hanno odore
ammoniacale, quelle superiori odore di pesce. Le ammine aromatiche sono
cancerogene. Essendo funzioni azotate ridotte, saranno ottenibili per riduzione
di altre funzioni azotate quali nitroderivati, ammidi, nitrili.
Nei casi complessi il gruppo NH2 viene chiamato ammino. Formano legami di
idrogeno intermolecolari (N - - - - H N ) che conferiscono punti di ebollizione abbastanza elevati inferiori
però a quelli dei corrispondenti alcoli in cui il legame di idrogeno (O - - - -
- H - O ) ha maggiore energia. Si sciolgono in acqua fino a C6. I
sali ammonici hanno le caratteristiche di composti ionici, cioè alto punto di
fusione e buona solubilità in acqua. Le ammine alifatiche inferiori hanno odore
ammoniacale, quelle superiori odore di pesce. Le ammine aromatiche sono
cancerogene. Essendo funzioni azotate ridotte, saranno ottenibili per riduzione
di altre funzioni azotate quali nitroderivati, ammidi, nitrili.
+3H2

![]() R - NO2 (nitroderivati)
R - NO2 (nitroderivati)
-2 H2O
O
|| + H2

![]()
![]() R - C −NH2 (ammidi) R - NH2
R - C −NH2 (ammidi) R - NH2
-H2O
+ H2
![]() R - C
N (nitrili)
R - C
N (nitrili)
Un secondo metodo di preparazione consiste nel trattare con ammoniaca gli alogenuri alchilici (esempio di sostituzione nucleofila): non è facile arrestare la reazione allo stadio di ammina primaria [202], la quale con una seconda molecola di alogenuro alchilico forma l'ammina secondaria [203], e così via fino al sale ammonico quaternario.
![]()
![]() R - X + NH3 R - NH2 + HX
R - X + NH3 R - NH2 + HX
![]()
![]() R
R
![]() R - X + R - NH2 N - H + HX [203]
R - X + R - NH2 N - H + HX [203]
![]()
R
Si osservino ora le principali reazioni delle ammine:
carattere basico: le ammine sono le tipiche basi della chimica organica; la loro basicità è legata
alla capacità di sottrarre protoni all'acqua secondo l'equilibrio [204]:
+
![]()
![]() R
- NH2 + H2O R - NH3 + OH−
R
- NH2 + H2O R - NH3 + OH−
Cui corrisponde una costante Kb [205]:
[ R - NH3 ] [ OH− ]
![]() Kb =
Kb =
[ R - NH2 ]
dell'ordine di 10-4 − 10-5 per le ammine alifatiche e 10-10 per le ammine aromatiche.
Ossidazione: dato il loro carattere fortemente ridotto, le ammine risultano facilmente ossidabili, sia dall'ossigeno dell'aria che dagli ossidanti chimici. A seconda del tipo di ammina si ottengono aldeidi, chetoni, acidi.
Acilazione: si è già vista l'acilazione dell'ammoniaca per formare ammidi [181]. Impiegando ammine si ottengono ammidi sostituite:
![]()
![]() H O H
H O H
||
![]()
![]()
![]()
![]()
![]()
![]() R - N + X - C - R R - N +HX
R - N + X - C - R R - N +HX
![]()
![]()
![]() H C - R
H C - R
![]() ||
||
O
H O
| ||
Si osservi che la formula R - N - C - R può essere interpretata come acilammina o come alchilammide.
Reazione con l'acido nitroso: trattando a freddo le ammine primarie in ambiente acido (HCl) con acido nitroso, generato in situ per reazione tra nitrito di sodio e acido cloridrico
![]() (NaNO2 + HCl NaCl + HNO2), si formano
i sali di diazonio.
(NaNO2 + HCl NaCl + HNO2), si formano
i sali di diazonio.

![]()
![]() H
H - OH R - OH +N2
+ HCl S
H
H - OH R - OH +N2
+ HCl S
A

 R - N R - N+
N Cl− +2 H2O L
R - N R - N+
N Cl− +2 H2O L
![]() I
I
H [207]
D
Ammina +HO - NO I


![]() alifatica
alifatica
+HCl
D
I
A
![]() H Z
H Z
O
![]() Ar - N Ar - N+
N Cl− + 2H2O N
Ar - N Ar - N+
N Cl− + 2H2O N
![]()
![]() I
I
H O
Ammina Azocoloranti Benzeni sostituiti
Aromatica
Quelli delle ammine alifatiche [207] sono instabili e si decompongono rapidamente, formando alcoli e azoto gassoso. Quelli delle ammine aromatiche [208] hanno vita più lunga, in soluzione (allo stato secco sono esplosivi), e si prestano a due reazioni fondamentali. Trattati con soluzioni alcaline di fenoli, come il 2-naftolo [209], sostituiscono l'idrogeno in posizione 1 formando un azocolorante[210]. Giocando sulla diversa struttura del fenolo e dell'ammina si ottengono svariati coloranti per la tintura di diversi substrati.
R
|
N
||
H N



 | |
| |
![]()
![]() HO HO
HO HO
![]()
![]()
![]()
![]()
![]() Ar - N+ N Cl-
+ +
HCl
Ar - N+ N Cl-
+ +
HCl
[208] [209] [210]
Trattati invece con sali inorganici quali CuCl, CuBr, KI, CuCN, svolgono azoto formando i corrispondenti benzeni sostituiti.
![]()
![]()
![]() Cl Br I
Cl Br I

[211] [212] [213]
Clorobenzene Bromobenzene Iodobenzene
![]()
![]()

 C N OH
C N OH
![]()
![]()
[189] [142]
Benzonitrile Fenolo
Anilina (C6H5NH2): capostipite delle ammine aromatiche, liquido, punto di ebollizione 185 C, tossica, pressoché insolubile in acqua. Si trova nel catrame di carbon fossile. Usata come solvente e nell'industria dei coloranti (colori di anilina = rossi).
COMPOSTI bi- e polifunzionali.
Fino a questo punto si sono pressoché sempre considerati composti contenenti, nella loro molecola, un solo gruppo funzionale. Capita però sovente di trovare strutture contenenti due o più gruppi funzionali, uguali o diversi tra loro. Nasce subito un problema di nomenclatura, il composto [214]:
H H H H H
| | | | |
H - C5 - C4 - C3- C2- C1 = O
| | | |
H H OH H
è da considerarsi un'aldeide che porta un ossidrile legato al carbonio C3 oppure un alcol che porta come sostituente il gruppo aldeidico - CHO ? In altri termini: è una idrossialdeide o un aldeidoalcol ? Per risolvere il problema le regole ufficiali hanno introdotto il concetto di GRUPPO PRIORITARIO, quello cioè che da il nome al composto, relegando eventuali altri gruppi al semplice ruolo di sostituenti. La scala di priorità decrescente ed il nome da attribuire ad un gruppo funzionale che non sia prioritario sono riportati nella tabella.
TABELLA - Gruppi funzionali in ordine di priorità decrescente e relativa denominazione in caso di non priorità
|
Gruppo funzionale |
Nome in caso di priorità |
Nome se non prioritario e considerato come sostituente |
||||||||||||||||
|
+ N
|
SALE AMMONICO |
|
||||||||||||||||
|
OH | − C = O |
ACIDO |
CARBOSSI |
||||||||||||||||
|
O - R | − C = O |
ESTERE |
ALCOSSICARBONILE |
||||||||||||||||
|
X | − C = O |
ALOGENURO DI ACILE |
ALOGENOCARBONILE |
||||||||||||||||
|
NH2 | − C = O |
AMMIDE |
CARBAMMILE |
||||||||||||||||
|
H | − C = O |
ALDEIDE |
FORMILE |
||||||||||||||||
|
|
CHETONE |
OSSO |
||||||||||||||||
|
− C N |
NITRILE |
CIANO |
||||||||||||||||
|
− OH |
ALCOL , FENOLO |
IDROSSI |
||||||||||||||||
|
− NH2 |
AMMINA |
AMMINO |
||||||||||||||||
|
− OR |
ETERE |
ALCOSSI |
Il composto [214] sarà pertanto una idrossialdeide ed il suo nome è 3-idrossipentanale. Gli alogeni (−X) ed i gruppi nitroso (−NO) e nitro (−NO2) sono sempre considerati come sostituenti e cedono il passo a tutti i gruppi funzionali.
Si prendono ora in esame alcuni composti singoli o classi di composti più significativi fra quelli riconducibili a questo famiglia (composti bi- e polifunzionali). Già si sono incontrati il glicole etilenico [ ], la glicerina [ ] ed i tre diidrossibenzeni isomeri [ ] fra gli alcoli ed i fenoli e gli acidi ftalici [ ] tra gli acidi. Un caso limite di acido dicarbossilico ai confini con la chimica inorganica è rappresentato dall'acido carbonico (H2CO3) che in formula di struttura [215] può essere visto come costituito da due carbossili aventi in comune un atomo di carbonio. Come tale potrà fornire dei mono- e dei diderivati quali i cloruri e le ammidi. Il monocloruro dell'acido carbonico è l'acido clorocarbonico [216], il dicloruro è il fosgene [217], aggressivo chimico largamente impiegato nella prima guerra mondiale; la monoammide è l'acido carbammico [218] (i cui esteri NH2 - CO - O - R sono chiamati uretani) e la diammide è l'urea [219], il più importante prodotto finale del metabolismo proteico nei mammiferi, usata come fertilizzante azotato e per fare materie plastiche.
![]()
![]()
![]() O - H Cl NH2
O - H Cl NH2
![]()
![]()
![]() O = C O =
C O = C
O = C O =
C O = C
O - H O - H O - H
Acido carbonico Acido clorocarbonico Acido carbamminico
[215] [216] [218]
![]()
![]() Cl NH2
Cl NH2
![]()
![]() O = C O = C
O = C O = C
Cl NH2
Fosgene Urea
[217] [219]
Il vero capostipite degli acidi dicarbossilici è l'acido ossalico [220], sostanza velenosa contenuta in molti vegetali; l'acido adipico [221] trova impiego nella fabbricazione del nylon. All'acido ossalico corrisponde il capostipite dei dinitrili, il di cianogeno [222].
COOH COOH C N
| | |
COOH (CH2)4 C N
COOH
Acido ossalico Acido adipico Dicianogeno
[220] [221] [222]
Tra i dichetoni hanno interesse i derivati ciclici quali il p-benzochinone [223], l'o-benzochinone [224] e l'antrachinone [225], capostipite di una importante famiglia di coloranti sintetici.
O O O
|| || ||




 O
O
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
|| ||
O O
p-benzochinone o-benzochinone Antrachinone
[224] [225]
Tra le diammine si citano la putrescina ( H2N - (CH2)4 - NH2) [226], la cadaverina (H2N - (CH2)5- NH2) [227] e la esametilendiammina ( H2N - (CH2)6 - NH2) [228] usata nella produzione del nylon.
I casi fin qui considerati sono costituiti da molecole nelle quali lo stesso gruppo funzionale è presente due o più volte. Restano da esaminare quelli in cui i gruppi funzionali sono diversi tra loro. Tra gli idrossiacidi chiamati anche ossiacidi, si ricordano l'acido lattico [229] che si forma nei muscoli per decomposizione del glicogeno sotto sforzo, l'acido tartarico [230], presente nella frutta e l'acido salicilico [231] usato come conservante alimentare e, sotto forma di estere con l'acido acetico, come principio attivo dell'aspirina.
CH3 COOH COOH
| | |
![]()
 H - C -
OH H - C - OH OH
H - C -
OH H - C - OH OH
![]() | |
| |
COOH OH - C - H
COOH
Acido lattico Acido tartarico Acido salicilico
[229] [230] [231]
Gli amminoacidi sono le unità monomeriche dalla cui condensazione (formazione di una ammide tra i carbossile di una molecola e l'amminogruppo di un'altra) prendono origine i protidi. Il loro capostipite è la glicina (acido 2-amminoacetico) che più verosimile scrivere nella forma di ione dipolare [232] in cui il protone è migrato dal sito acido a quello basico della molecola [233].
![]()
![]() H2N - CH2
- COOH H3N
- CH2 - COO−
H2N - CH2
- COOH H3N
- CH2 - COO−
[232] [233]
Con il termine eterociclo si comprendono quei composti ciclici in cui almeno uno degli atomi che costituiscono l'anello non è carbonio, ma un eteroatomo (i più comuni eteroatomi sono N, O, S). Si riportano qui nome e formula di alcuni eterocicli fondamentali:

O S N
│
H
Furano Tiofene Pirrolo
[234] [235] [236]
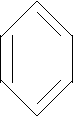
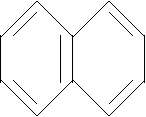
N N
Piridina Chinolina
[237] [238]
Gli eterocicli costituiscono la struttura di base di numerosi composti naturali quali alcaloidi, acidi nucleici, vitamine, coloranti naturali e di composti di sintesi industriale quali farmaci, coloranti e prodotti per l'agricoltura.
Tra i composti bifunzionali si è incontrato l'acido lattico [229]. Se, modelli alla mano, si costruiscono la configurazione [239 a] e la sua immagine speculare [239 b], è immediato constatare che si hanno tra le mani due oggetti fisicamente diversi, da qualunque parte li si guardi. L'unico modo per farli coincidere è quello di intervenire su uno dei due modelli scambiando di posto due gruppi, presi a caso. Quanto basta per parlare di isomeria, cioè di molecole diverse, pur essendo fatte con gli stessi atomi. La differenza risiede nella diversa disposizione nello spazio (stereoisomeria) dei gruppi legati al carbonio.
![]()
![]()
![]() A COOH B. COOH
A COOH B. COOH
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() H C* OH HO C* H
H C* OH HO C* H
![]()
![]()
![]()
![]()
![]()
CH3 CH3
Acido lattico
[239]
Già si sono incontrati esempi di stereoisomeria a proposito dell'isomeria geometrica e dell'isomeria conformazionale. Si dice che la coppia di strutture [239 a] e [239 b], costituita da forme assimilabili ad un oggetto ed alla sua immagine speculare non coincidenti tra loro, rappresenta due antipodi ottici o enantiomeri o stereoisomeri ottici. L'origine del termine "ottico" è legata all'osservazione sperimentale del comportamento di una soluzione, contenente come soluto solo molecole dell'antipodo [239 a], quando venga attraversata da un raggio di luce polarizzata, cioè vibrante in un piano ben definito. All'uscita della soluzione, il piano di vibrazione della luce risulta ruotato verso destra di un certo numero di gradi. Si dice per tanto che la molecola [239 a] è dotata di attività ottica, è otticamente attiva e rappresenta l'antipodo ottico DESTROGIRO ( simbolo +). Analogo esperimento su [239 b]: il piano risulta deviato dello stesso numero di gradi, ma nel verso opposto, dall'antipodo LEVOGIRO (simbolo −). Una miscela equimolecolare di due antipodi è otticamente inattiva in quanto il piano di vibrazione riceve impulsi uguali ma di segno opposto; tale miscela è detta MISCELA RACEMICA o RACEMATO.
Quali relazioni vi sono fra struttura e attività ottica ? La risposta è apparentemente molto semplice: sono otticamente attive tutte le molecole asimmetriche.
Come fare a stabilire se una molecola è asimmetrica ? Vi sono vari metodi. In laboratorio è sufficiente fare una soluzione della sostanza ed esaminarla al polarimetro: questo strumento dirà se, di quanto e in quale verso è ruotato il piano di polarizzazione della luce, o se non è ruotato affatto (caso di sostanza inattiva o di racemato). Un altro metodo consiste nel fare il modello della molecola (a patto di conoscerne la struttura), di farne l'immagine speculare e di verificare se i due modelli sono identici o no: nel primo caso si avrà molecola simmetrica ed inattiva, nel secondo caso il contrario. La nostra mano sinistra è tipica struttura asimmetrica. Se la si presenta davanti ad uno specchio e se ne "estrae" l'immagine, che è la mano destra, si constaterà che sono diverse. C'è tuttavia un metodo più semplice per verificare la asimmetria molecolare. Una molecola è asimmetrica ed otticamente attiva quando possiede un atomo di carbonio asimmetrico; è tale un carbonio che risulti legato a quattro atomi o gruppi atomici diversi tra loro. È il caso del C* in [239], legato ad un idrogeno, un ossidrile, un metile ed un carbossile. In una molecola ci può essere più di un atomo di carbonio asimmetrico: in questo caso è quasi scontato che ci sia attività ottica, senza però che questa si riscontri nel 100% delle situazioni. Ad esempio, con due atomi di carbonio asimmetrici equivalenti si può avere ½ molecola che ruota a destra e ½ che ruota a sinistra. In questo caso la molecola risulta otticamente inattiva per compensazione interna.
Schema di funzionamento di un polarimetro:

![]()
![]()
![]()

![]()
P C A O
![]()
 S
S
![]()

L LP LR
Dove: S sorgente di luce
P lente polarizzatrice
C campione da esaminare
A lente analizzatrice
O osservatore
L luce emessa dalla sorgente
LP luce polarizzata
LR luce polarizzata dopo il passaggio in campione otticamente attivo
L'angolo di rotazione del piano di oscillazione della luce polarizzata dipende dalla lunghezza della cella, dal tipo di sostanza e dalla sua concentrazione.
Si tratta di una categoria molto vasta di sostanze nella quale emergono tre grandi famiglie di composti:
GLICIDI
PROTIDI
LIPIDI
Al di fuori di queste, alcune sostanze non trovano una collocazione precisa anche se svolgono negli organismi viventi funzioni particolari. Le vitamine sono sostanze attive, indispensabili in piccole quantità all'organismo per lo svolgimento dei suoi processi vitali ed dall'organismo stesso non sintetizzabili a partire da altri composti chimici. È pertanto importante una dieta appropriata che garantisca l'introduzione di queste molecole preziose (o di loro precursori) nell'organismo. Le principali sono: vitamina A, prodotta dalla trasformazione dei caroteni, utile per la vista, le vitamine del gruppo B con effetti antianemici ed antidermatitici, la vitamina C ad azione antiscorbutica, le vitamine D contro il rachitismo, la vitamina E antiossidante come la C e la A. Le vitamine K ad effetto antiemorragico (A, D, E, K sono liposolubili, le altre sono idrosolubili).
Gli ormoni sono sostanze prodotte da ghiandole e mucose che, agendo a bassissime concentrazioni, stimolano o incrementano l'attività delle cellule, favorendo vari tipi di crescita.
Gli enzimi sono i tipici catalizzatori che controllano rigidamente le reazioni chimiche legate ai processi vitali. Appartengono strutturalmente ai protidi e sono distribuiti in tutte le cellule del regno animale e vegetale.
Vitamine, ormoni ed enzimi rientrano in una dizione più generale che li considera come biocatalizzatori.
Gli antibiotici sono sostanze prodotte da vegetali (miceti e piante superiori) o per sintesi, che impediscono lo sviluppo, o uccidono determinati microrganismi patogeni.
Gli alcaloidi sono sostanze prodotte essenzialmente dai vegetali dotate di proprietà basiche. Presentano spiccata attività fisiologica come anestetici, eccitanti, droghe. Tra i più comuni si ricordano la nicotina, la cocaina, la chinina, la morfina.
I coloranti organici naturali, responsabili della vasta gamma di toni reperibili nei vegetali e negli animali, si trovano nella forma insolubile di pigmenti. Si ricordano i flavonoidi (colori di fiori e frutti), i caroteni, l'indaco, le melanine, la clorofilla. Molti posseggono proprietà tintorie nei confronti dei più svariati substrati.
Glicidi
Questa famiglia di composti organici è conosciuta con numerose denominazione alternative: carboidrati, idrati di carbonio, saccaridi, zuccheri.
Si classificano in:
MONOSACCARIDI molecole contenenti da tre a nove atomi di carbonio non idrolizzabili in composti più semplici.
OLIGOSACCARIDI riconducibili alla policondensazione di un massimo di dieci monosaccaridi; molto importanti i disaccaridi.
POLISACCARIDI: condensazione da undici ad alcune migliaia di monosaccaridi.
Monosaccaridi
Pur senza essere il capostipite, il glucosio è il monosaccaride più diffuso ed importante. La sua formula bruta è C6H12O6 ed il comportamento chimico è quello di un composto polifunzionale: una pentaidrossialdeide (un gruppo aldeidico, quattro gruppi alcolici secondari, un gruppo alcolico primario). La sua struttura può essere rappresentata in quattro modi diversi [240], [241], [242], [243]:
H H
| |
1C = O 1C = O
|
2C*H OH H −2C* - OH
|
3C*H OH HO - 3C* - H
| |
4C*H OH H - 4C* - OH
| |
5C*H OH H - 5C* - OH
| |
6CH2OH CH2OH

HO - 1C* - H 6CH2OH
![]() |
|
 H - 2C*
- OH 5
* O
H - 2C*
- OH 5
* O
| H OH
![]()
![]() HO - 3C* - H H
HO - 3C* - H H
![]()

 | O 4 * 1 *
| O 4 * 1 *
![]() H - 4C*
- OH
H - 4C*
- OH
| OH OH H H
![]()
![]()
![]() H - 5C*
H - 5C*
![]() | 3 * 2 *
| 3 * 2 *
6CH2OH
H OH
La prima formula [240] è quella di pentaidrossiesanale. Nella seconda [241] si tiene conto del fatto che C2, C3, C4, C5 sono atomi di carbonio asimmetrici, per cui il disporre i gruppi H ed OH a sinistra o a destra diventa importante (si ricordi quanto succedeva in [239], isomeria ottica); una semplice regole dice che, se gli atomi di carbonio asimmetrici sono n, il massimo numero di stereoisomeri ottici risultanti sarà 2n, 16 in questo caso. La scrittura [241] indica pertanto uno specifico isomero ottico, fra i 16 possibili. Le formule [240] e [241] sono a catena aperta.
Nella maggior parte dei testi si trovano le formule cicliche. Si ricordi che per reazione di un gruppo aldeidico con un gruppo alcolico si forma un semiacetale; la stessa cosa avviene fra il gruppo aldeidico del glucosio e l'ossidrile alcolico legato al C5, con la formazione di un semiacetale ciclico. La formula [242] è infatti definita ciclosemiacetalica (secondo la proiezione proposta da FISCHER). Si noti che ora i C* sono saliti a cinque e gli stereoisomeri possibili sono 25=32. Un anello a sei termini risulta più coerente in forma esagonale. E' quanto si verifica nella formula [243], chiamata CICLOSEMIACETALICA PIRANOSICA, secondo la proiezione proposta da HAWORTH La parola piranosica deriva dal nome dell'eterociclo a sei termini contenente un atomo di ossigeno, chiamato pirano. Si noti infine che il reale assetto geometrico dell'anello piranico non è planare, come rappresentato in [243], ma a sedia come nel caso del cicloesano è [ ].
La NOMENCLATURA dei carboidrati prevede la desinenza ufficiale - oso. Il glucosio costituisce un esempio di aldoesoso (aldo = aldeide, es = sei atomi di carbonio, oso = desinenza ufficiale) e sarebbe più proprio chiamarlo glucosio
Isomero strutturale del glucosio è il fruttoso (fruttosio), anch'esso di formula C6H12O6 .

1CH2OH HO - 2C* - 1CH2OH
| |
2C = O HO - 3C* - H O
![]() | |
| |
HO - 3C* - H H - 4C* - OH
| |
![]() H - 4C* -
OH H - 5C*
H - 4C* -
OH H - 5C*
| |
H - 5C* - OH 6CH2OH
|
6CH2OH
 O
O
6CH2OH OH
![]()
![]()

 5 * * 2
5 * * 2
H 1CH2OH
![]()
![]() H OH
H OH
![]() 4 * * 3
4 * * 3
OH H
Come risulta dalla formula [244], questa volta si tratta di un pentaidrossichetone o chetoesoso ( cheto = chetone, es = sei atomi di carbonio , oso = desinenza ufficiale). Rispetto al glucoso ha un carbonio asimmetrico in meno. Sono riportate le proiezioni di Fisher [245] e di Haworth [246]. Quest'ultima è detta ciclosemiacetalica furanosica, dal nome del furano [234], eterociclo pentatomico con un atomo di ossigeno. Si ricordano inoltre i due capostipiti, aldeide glicerica [247], che è il più semplice aldotrioso e il diidrossiacetone [248] che è il più semplice chetotrioso.
CHO CH2OH
| |
H - C - OH C = O
| |
CH2OH CH2OH
Disaccaridi
La formula [249] è risultante dall'eliminazione di acqua (condensazione) tra due ossidrili, uno del glucoso ed uno del fruttoso (C12H22O11). Si potrebbe dire che è un etere (si ricordi che alcol + alcol - H2O = etere). Questo è però un caso particolare poiché la condensazione coinvolge gli ossidrili semiacetalici, cioè gruppi alcolici altrettanto particolari. L'etere risultante è infatti, a differenza dagli eteri tradizionali, facilmente idrolizzabile, sia ad opera di acidi diluiti, che di enzimi (invertasi). Se si analizza al polarimetro una soluzione di saccaroso si misura un potere rotatorio specifico (α) di +66°; aggiungendo acido cloridrico si osserverà una inversione del segno della rotazione che risulterà levogira, in quanto i prodotti dell'idrolisi sono glucosio (α=+53°) ed il fruttosio (α=-92°) ed il verso di quest'ultima rotazione sarà prevalente.
CH2OH
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() O O H O H CH2OH O H
O O H O H CH2OH O H
![]()
![]()
![]()
![]() -
H2O H
-
H2O H
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() + OH H H OH
+ OH H H OH
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() OH OH HO O CH2OH
OH OH HO O CH2OH
H OH OH H
[243] [246] [249]
Polisaccaridi
Ogni unità di glucoso è un alcol pentavalente. Mettendo in gioco due di questi ossidrili (quelli in C1 e quello in C4), il glucoso può essere paragonato al vagone di un treno che si aggancia (formazione di ponti eterei -O-) testa coda (C1 - C4) con i suoi simili. Ne risultano tre importantissimi polisaccaridi: amido, glicogeno, cellulosa. Si riporta la struttura della cellulosa (C6H11O5)n [250].
![]()
![]()
![]() CH2OH CH2OH CH2OH
CH2OH CH2OH CH2OH
![]()
![]() O O O
O O O
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() O O O O
O O O O
![]()
![]()
![]()
![]()
![]()
![]() OH OH OH
OH OH OH
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
OH OH OH
Ogni unità glicosidica del polimero naturale cellulosa contiene tre ossidrili alcolici in grado di essere esterificati in varia misura da acidi (monoesteri, diesteri, triesteri). Gli esteri con l'acido acetico si chiamano acetati di cellulosa o acetilcellulose ed hanno importanza come fibre (rayon), quelle con l'acido nitrico si chiamano nitrati di cellulosa o nitrocellulose ed hanno importanza come esplosivi (fulmicotone).
GLUCOSIO (C6H12O6) [243]: solido, punto di fusione 146°C, solubile in acqua. È anche chiamato destrosio ed è il monosaccaride più diffuso in natura (nei frutti, nel nettare dei fiori, nel sangue umano). Si ottiene industrialmente per idrolisi dell'amido o della cellulosa. Per fermentazione può fornire alcol etilico, glicerina, acido lattico, acido citrico. Usato nell'industria dolciaria, enologica, farmaceutica, nella preparazione dei mangimi, nelle fleboclisi.
FRUTTOSIO (C6H12O6) [246]: solido, punto di fusione 103°C, solubile in acqua. È anche chiamato levulosio o zucchero di frutta data la sua costante presenza nei frutti dolci. Si usa come dolcificante nelle diete dei diabetici per conferire omogeneità ai gelati.
SACCAROSIO (C12H22O11) [249]: solido, solubile in acqua, si decompone tra 160° e 185°C (caramello). È lo zucchero per eccellenza e si trova nella canna e nella barbabietola da zucchero da cui si estrae. Oltre ai ben noti impieghi alimentari si usa per fare inchiostri, materie plastiche, saponi trasparenti.
MALTOSIO (C12H22O11): è un disaccaride formato da due unità di glucoso. È presente nel malto d'orzo e di altri cereali e dalla sua fermentazione si ottiene la birra.
AMIDO (C6H10O5)n : è il polisaccaride, a base di unità glucosidiche, sintetizzato a partire dall'anidride carbonica nel corso della fotosintesi clorofilliana. È particolarmente abbondante nei cereali e nelle patate e costituisce la più importante sostanza di riserva dei vegetali. È costituito per il 30% da catene lineari di peso molecolare tra 20000 e 200000 (amiloso) e per il 70% da catene ramificate di peso molecolare tra 50000 e 1000000 (amilopectina). È materia prima per numerosi prodotti di trasformazione (destrine, glucoso, maltoso) e, tal quale, trova impiego in dietetica, nell'industria farmaceutica e tessile.
GLICOGENO (C6H10O5)n : è un polisaccaride molto simile all'amido, con catene maggiormente ramificate, peso molecolare fra i 300000 e 3000000. E' il carboidrato di riserva degli animali, prodotto dal fegato e presente nei muscoli: sotto sforzo si trasforma in acido lattico [229], con il riposo se ne ha la risintesi.
CELLULOSA (C6H10O5)n [250] : è il polisaccaride del glucoso, di peso molecolare tra 300000 e 2000000, presente nei vegetali con funzione prevalente di sostegno. Il legno è costituito per il 50% da fibre cellulosiche, agglomerante dalla lignina. Il cotone è cellulosa al 100%. Trova impiego nella fabbricazione della carta, di polimeri (cellophane e celluloide) e di fibre ed esplosivi.
Protidi
Con questo termine si allude ad una importantissima classe di composti naturali noti anche sotto il nome di sostanze proteiche o proteine. Si tratta di polipeptidi di alto peso molecolare (> 10000) che si trovano in natura in tutti i tessuti viventi animali, vegetali e batterici. Esplicano funzioni importantissime come catalizzatori, come regolatori del metabolismo e come anticorpi. Le unità monometriche dalla cui policondensazione derivano i protidi sono gli aminoacidi. Qui di seguito [251] è raffigurato il prodotto risultante dalla eliminazione di acqua tra il carbossile di un aminoacido e l'amminogruppo di un altro aminoacido (uguali o no tra loro): ne risulta una ammide il cui legame ammidico, indicato dalla freccia, prende, nel caso di queste ammidi particolari, il nome di legame peptidico.

R O H R΄ R O H R ΄
![]()
![]()
![]() | || | | -H2O | || | |
| || | | -H2O | || | |
![]()
![]() H2N - CH -
C - OH + H - N - CH - COOH H2N
- CH - C - N - CH - COOH [251]
H2N - CH -
C - OH + H - N - CH - COOH H2N
- CH - C - N - CH - COOH [251]
![]()
![]()
Dalla condensazione di due aminoacidi risulta un dipeptide [251], di tre un tripeptide, di molti un polipeptide; se gli aminoacidi policondensati sono in numero tale da conferire un peso molecolare superiore a 10000 si ottengono le proteine.
Particolare importanza rivestono le proteine contenute nei nuclei e nei citoplasmi delle cellule (nucleo protidi). La parte più delicata ed attiva di tali protidi è costituita dagli acidi nucleici, riconducibili a due tipi fondamentali: DNA (acidi deossiribonucleici) e RNA (acidi ribonucleici). Gli acidi nucleici esplicano funzioni vitali importantissime in quanto presiedono al metabolismo, alla riproduzione ed alla crescita degli organismi animali e vegetali. Si è molto parlato in anni recenti di bioproteine. Si tratta di sostanze proteiche, utilizzabili come mangimi, ottenibili dall'azione di microrganismi (batteri, alghe, lieviti, miceti) su alcani con 10 - 20 atomi di carbonio. In linea di principio la cosa appare di grande interesse per la soluzione del problema del riempimento di materie prime alimentari.
Lipidi
Sono quei composti dei sistemi viventi praticamente insolubili in acqua e solubili in solventi organici apolari, quali etere, cloroformio e benzene. Secondo la funzione svolta negli organismi viventi, si classificano in :
Lipidi di riserva (gliceridi);
Lipidi protettivi (cere);
Lipidi cellulari (steroidi, fosfolipidi, glicolipidi).
I grassi naturali presenti nei vegetali e negli animali sono gli esteri della glicerina [ ] con acidi aventi 16, 17, 18 atomi di carbonio chiamati acidi grassi. In [252] è rappresentato un generico triestere della glicerina, chiamato trigliceride (esistono ovviamente anche i monogliceridi ed i digliceridi):
O
||
![]() CH2 - O - C - (CH2)n
- CH3
CH2 - O - C - (CH2)n
- CH3
O
||
CH - O - C - (CH2)n - CH3 [252]
![]() O
O
||
CH2 - O - C - (CH2)n - CH3
Gli acidi grassi più comuni sono il palmitico [253], lo stearico [254] e l'oleico [255] ed i rispettivi trigliceridi hanno i nomi correnti di tripalmitina, tristearina e trioleina. I grassi, riscaldati al punto di fumo, si decompongono principalmente in acroleina (CH2 =CH - CHO) [ ], che li rende meno digeribili. Quando sono bassofondenti o oli (la cosa è legata alla presenza di numerosi doppi legami), possono essere idrogenati (addizione di idrogeno sui doppi legami che diventano saturi) fornendo così le margarine. La più importante reazione dei grassi è legata alla loro idrolisi.
CH3 - (CH2 )14 − COOH CH3 - (CH2 )16 − COOH CH3 - (CH2 )7 - CH = CH3 - (CH2 )7 - COOH
[253] [254] [255]
Si è visto che gli esteri, e come tali anche i grassi, vengono idrolizzati [ ] in ambiente basico nel corrispondente alcol, che in questo caso è glicerina, e nel sale sodico del relativo acido (R-COO− Na+) che in questo caso sarà palmitato, stearato ad oleato di sodio. Questi ultimi sali altro non sono che i comuni saponi e pertanto l'idrolisi alcalina dei grassi prende il nome di saponificazione. I sali sodici sono saponi duri, quelli potassici (ottenuti impiegando KOH) sono saponi molli. L'azione detergente dei saponi è legata alla capacità di formare micelle [256]. Le catene idrocarburiche idrofobe si attraggono reciprocamente, inglobando le particelle di sporco e formando una corona sferica esterna costellata di gruppi polari (−COO− Na+) che rendono il tutto, sporco compreso, solubile nell'acqua di risciacquo. I saponi sono nemici delle acque dure, i cui ioni Ca++ e Mg++ li trasformano in sali di Ca e Mg, insolubili e quindi inattivi.
I detersivi in genere rappresentano una variazione sul tema sapone. Si tratta, anche in questo caso, di strutture anfipatiche [257] il cui meccanismo di azione ricalca quello dei saponi. Se le catene sono rigorosamente lineari, i detersivi presentano una facile biodegradabilità.
![]() PARTICELLA DI SPORCO
PARTICELLA DI SPORCO
![]()
![]()
![]()
![]()
![]() GRUPPO COOH
GRUPPO COOH
(IDROFILA)
![]()
![]()
![]()
![]()
![]() CATENA
IDROFOBA
CATENA
IDROFOBA

![]()
![]()
![]() TESTA
TESTA
CORPO IDROFOBO
![]()
![]() IDROFILA
IDROFILA
![]()
Le cere sono strutturalmente degli esteri (R−COOR') nei quali sia l'acido (catena R), sia l'alcol (catena R') sono caratterizzati da una lunga sequenza di atomi di carbonio (da 8 fino a 36 unità). Si ricordano la cera d'api e la lanolina (grasso di lana).
Tra i lipidi cellulari si citano gli steroidi (steroli, acidi biliari, ormoni) che hanno, come scheletro fondamentale, il sistema tetraciclico dello sterano.
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2024