|
|
| |
CHIMICA PER I BENI CULTURALI II
Programma:
Introduzione- storia della chimica analitica applicata ai Beni Culturali - Indagini qualitative e quantitative - Analisi distruttive e non - Elaborazione dei risultati analitici - Scopi delle indagini analitiche
CAMPIONAMENTO: Il campione in situ: Sopralluogo - Campionamento - Conservazione dei campioni
Il campione in laboratorio: Schedatura del campione - Allestimento di sezioni lucide trasversali e sezioni sottili - Solubilizzazione - Macinazione
DEGRADO MATERIALI LAPIDEI cause di degrado chimico-fisico - studio analitico dei fenomeni di degrado.
Le indagini analitiche: Morfologia (microscopia ottica e elettronica) - Composizione e analisi elementare (spettroscopie FTIR, Raman e UV-vis, spettroscopia di assorbimento ed emissione atomica, analisi termiche)- separazione e analisi di miscele complesse (tecniche cromatografiche, spettroscopie ICP/MS e GC/MS) - analisi della superficie (tecniche superficiali) - struttura del campione (diffrazione di raggi X)- analisi in situ (strumentazione portatile).
TECNICHE SPETTROSCOPICHE
TECNICHE SPETTROSCOPICHE ATOMICHE
ANALISI TERMICHE E TERMOGRAVIMETRICHE
DIFFRAZIONE E TECNICHE SUPERFICIALI
RIASSUNTO DELLE TECNICHE
TESTI:
Dispense
M. Matteini, M. Moles, la Chimica nel restauro, Nardini editore, Firenze
M. Matteini, M. Moles, Scienza e restauro, Nardini editore, Firenze
L. Appolonia, S. Volpin, Le analisi di laboratorio applicate ai beni artistici policromi, casa editrice il Prato, Padova
INTRODUZIONE:
Le indagini di chimica analitica si fanno domande sullo studio della tecnica di esecuzione, sulla provenienza (datazione e autenticazione), sullo stato di conservazione (studio del livello di degrado e delle interazioni del manufatto con l'ambiente, ricostruzione della storia conservativa), controllo delle condizioni di conservazione (monitoraggio e diagnostica).
INDAGINE ANALITICA:
di solito si compie estraendo dei campioni dal manufatto, che contiene analiti e matrice. Dopodiché si applicano diverse tecniche di indagine che permettono di analizzare gli analiti dal punto di vista qualitativo (natura degli analiti) e dal punto di vista quantitativo (concentrazione degli analiti).
I METODI DI INDAGINE
Si classificano in 2 macro- tipologie:
Misure di massa e di volume
Misura di una grandezza proporzionale alla quantità di analita presente nel campione
Oppure secondo proprio il modo di indagine:
Metodi gravimetrici: si determina la massa dell'analita
Metodi volumetrici: Si determina il volume tramite la reazione dell'analita con un reagente inserito apposta nel campione
Metodi elettro-analitici: si misurano proprietà elettriche (potenziale, corrente, resistenza)
Metodi spettroscopici: studia l'interazione con le radiazioni con l'analita
Il metodo di indagine da scegliere non è solo per i fattori di indagine, ma c'entrano anche motivazioni diverse, come quelle economich 424e49e e, di tempo, di accuratezza richiesta.
CAMPIONAMENTO:
Il campione deve essere rappresentativo del fenomeno da indagare; il campione però deve essere trattato, con dissoluzione del campione e eliminazione delle interferenze.
Anche nell'analisi stessa dell'analita, vanno considerate nell'ottica della sua misura fisica che viene considerata; questa calibrazione viene ricostruita empiricamente con la bontà di una certa quantità di conferme statistiche. Ad esempio consideriamo i limiti di identificazione qualitativa e quantificativa dell'analita.
Limite di rivelabilità (detection limit)- la più piccola quantità rilevabile di un elemento. Bisogna sempre considerare l'errore di calcolo, che va comunque stimato, di solito in percentuale. E ovviamente più è sensibile, più è basso il livello di rivelabilità, perché al di sotto di questa soglia lo strumento non percepisce neanche la presenza di una certo analita.
Tuttavia bisogna considerare che più uno strumento è preciso, più esso è complesso e quindi soggetto ad errori. Ovviamente conta molto la stima che si può fare prima.
Limite di quantificazione - la minima quantità quantificabile. Di solito rispetto al limite di rivelabilità, il limite di quantificazione è superiore di almeno 3 volte, perché non devi solo rilevarne la presenza, ma devi anche misurarlo! Infatti in genere, il limite di rivelabilità non viene neanche calcolato, anche perché di solito si può stimare la presenza di certi elementi.
La concentrazione degli analiti si esprime con di solito queste unità di misura:
Molarità: moli su analita / litri di soluzione
Percentuale in peso: massa analita / massa di soluzione X 100
Ppm: mg analita / kg di soluzione (o unità di misura più piccole)
02-CAMPIONAMENTO-
Prima del campione, bisogna effettuare almeno un Sopralluogo, che deve fare:
valutazione generale del manufatto da campionare
individuazione delle problematiche da indagare
progettazione del campionamento
progettazione delle misure in situ e di microclima
Dopo ciò, si può effettuare un campionamento ovvero il prelievo di campioni al fine di fare analisi o classificazione. Prima di procedere, bisogna però avvisare la soprintendenza (intervieni su un bene culturale), il committente (perché si spendono soldi), il direttore dei lavori (in genere un ingeniere), il team scientifico e il restauratore (valuta se il Campionamento è effettuabile e dove). Bisogna anche registrare le condizioni a cui è esposta.
CARATTERISTICHE DEL CAMPIONAMENTO
Deve essere progettato bene, in modo da effettuare i prelievi minimi necessari a rispondere ai quesiti su cui ci si pone il problema. Perciò bisogna scegliere anche bene la zona più rappresentativa dove prelevare un campione. Va prelevato in modo che sia piccolo (per non deturpare) e profondo (consideri tutta la stratigrafia).
Progettazione del campionamento in funzione delle INDAGINI da condurre
Scelta delle aree più SIGNIFICATIVE
Prelievo del NUMERO MINIMO di campioni
DIMENSIONI MINIME dei campi
RAPPRESENTATIVITÀ delle problematiche da indagare (forme di degrado, integrazioni, residui di trattamenti di passati interventi) e dei materiali presenti sull'opera
_ MINIMO DANNO alla leggibilità dell'opera
TIPI DI PRELIEVI-
Totali = asportazione di un grosso frammento che preleva tutti gli strati (bisturi e aghi)
Selettivi = prelievo di un solo strato omogeneo (problemi di inquinamento tra gli strati) (bisturi e aghi)
Biologici = uso delle piastre di contatto per individuare i biodeteriogeni presenti.
ATTENZIONE! Il campionamento DEVE precedere qualsiasi intervento che introduca nel campione materiali estranei che potrebbero inquinare ed inficiare le indagini analitiche
CARATTERISTICHE PIU' PRATICHE- Poi ci sono altre caratteristiche più pratiche:
Utilizzo di STRUMENTAZIONE opportuna; bisogna sempre tenere sempre i guanti per evitare contaminazioni organiche col grasso delle mani. Vanno usati anche strumenti diversi per i diversi materiali:
micro-bisturi (raschiare) per i dipinti
scalpelli per le malte
nastro adesivo di carta per attaccare le polveri e i pigmenti
bastoncini ovattati (cotton-fiocc) leggermente imbevuto per catturare le sostanze organiche che vengono sciolte dal liquido scelto passando il bastoncino sulla superficie.
Carotatrici (piccole ma che vanno in profondità), molto adatte alle murature (per vedere se ci sono cripto-efflorescenze)
Piastre a contatto (per azioni contro biodeteriogeni) sono piastre con un terreno di coltura adatto per i micro-organismi e vedere quali si espandono anche sulla piastra, che però provengono dal manufatto. Quindi sapendo la specie, possiamo scegliere il biocida adatto ad eliminarli.
DESCRIZIONE E DOCUMENTAZIONE grafica e fotografica della campagna di campionamento. Bisogna anche evidenziare bene la parte in cui viene effettuato il campionamento (indicando sempre l'etichetta del campione).
Localizzazione del punto di campionamento su di un rilievo
Descrizione del punto di campionamento
fotografia a del punto di campionamento
Descrizione del campione prelevato (perché è stato campionato? A quali domande si vuole rispondere? Ipotesi di analisi da eseguire)
Etichettatura dei campioni (per esempio: sigla manufatto+numero progressivo con collocazione precisa e descrizione del campionato)
CONSERVAZIONE CAMPIONI Bisogna proteggere i campioni fino al laboratorio.
I porta-campioni devono:
essere inerti
proteggere i campioni dall'ambiente
mantenere integri i materiali friabili
Tipi di porta-campioni usati (evitando contenitori in vetro e di fortuna o riciclati)
piastre di contatto con terreni di coltura
provette e buste di plastica monouso con tappo ermetico
piastre Petri
IL CAMPIONE IN LABORATORIO-
Scheda del campione - Permette di fare un programma di indagine, così che possiamo passare dal macro al micro, all'analisi chimica vera e propria. Osservo al microscopio ottico, collegato ad una camera video, così posso vedere i micro-organismi, le efflorescenze, trovando spesso strati più complessi e compositi del previsto. La scheda che accompagna il campione al suo arrivo in laboratorio comprende:
foto del campione tal quale a basso n° di ingrandimenti
descrizione (dimensioni, colore, ecc. ecc.)
problematiche da indagare
progettazione delle analisi da eseguire (tipo di analisi-sequenza-forma del campione necessaria)
Preparazione del campione Il campione non si può analizzare così come è, ma vanno sezionate.
Le sezioni permettono di osservare e analizzare la stratigrafia di un campione con indagini ottiche e chimiche (microscopia ottica ed elettronica, analisi spettroscopiche). Il fatto è ancora più importante se consideriamo che molte opere hanno una struttura a più strati sovrapposti.
SEZIONI LUCIDE TRASVERSALI (cross section)- Bisogna
usare anche un piccolo frammento, ma che sia  completo, ovvero che mostri tutti
gli strati. Presentano una superficie piana costituita dalla sezione del
campione perpendicolare alla superficie dell'opera
completo, ovvero che mostri tutti
gli strati. Presentano una superficie piana costituita dalla sezione del
campione perpendicolare alla superficie dell'opera
Preparazione Il frammento rappresentativo dei fenomeni da studiare viene INGLOBATO in un cilindro di resina dura (diametro 3cm), che funge da supporto. E' importante che la resina scelta (di solito resine epossidiche)sia trasparente, incolore e capace di indurire omogeneamente (senza creare tensioni o contrazioni e senza intervento termico).
Cilindro cavo di plastica con la base aperta, da dove verso la resina. Poi metto il campione sopra in modo che mostri tutte le sue sezioni. Poi metto un altro cilindro di resina sopra. Così il campione rimane perfettamente fermo e stabile all'interno del cilindro.
Taglio- Bisogna avvicinare il più possibile il campione alla superficie per renderlo analizzabile. Prima si usa una carta abrasiva più grossa quando si è lontani e poi con grana finissima quando arriviamo in prossimità del campione. Otteniamo una sezione piana, utile a molte indagini analitiche.
Lucidatura- sempre con una carta abrasiva, con granulometria sempre più fine (fino alle paste diamantate o con legante organico), per spianare completamente e soprattutto per rendere più lucida la superficie del campione, per ovviare e migliorare alcuni aspetti: la rugosità può modificare la luce, e la lucentezza rende più luce nell'analisi, facilitandola.
SEZIONI SOTTILI- Presentano due superfici piane e parallele della sezione del campione distanziate così poco tra loro da risultare semitrasparenti (pochi micron).
Si taglia il campione in sezioni sottilissime, che vengono ottenute in 2 modi:
Assottigliamento progressivo mediante abrasione di una cross-section, con grande cautela sempre con paste abrasive finissime.
Taglio con microtomi, fornisce tante sezioni di un unico frammento (perché lo taglia in più punti), così che su più sezioni simili si possono fare indagini di tipo molto diverso. Però in generale i campioni delle opere d'arte in genere si prestano poco al taglio.
Le sezioni vengono osservate al microscopio ottico in luce polarizzata per riconoscere le fasi cristalline presenti; per questo è una sezione più usata in geologia che nei beni culturali, ma nel caso di materiali lapidei è utile perché ci da informazioni in più sui silicati.
Queste sono le preparazioni dei campioni più utilizzate, ma ce ne sono altre:
MACINAZIONE- Si ottiene dal campione solido una polvere omogenea adatta ad essere sottoposta al processo di solubilizzazione o ad essere direttamente analizzata. Le altre tecniche viste il campione si manteneva integro. Se possibile, si macinano separatamente gli strati, fino ad avere polveri diverse ma con tipi omogenei. Bisogna soltanto stare attenti alle perdite di campione.
Vengono usati mortai a palle o in agata o in acciaio
SOLUBILIZZAZIONE- Si fanno sciogliere i campioni in diversi solventi, controllando poi il metodo d'attacco con dei campioni di riferimento standard. I metodi più usati:
acqua distillata, solvente universale (perché i Sali disciolti interferirebbero)
digestione acida (HCl, HNO3, HClO4, H2SO4 anche insieme) per campioni non solubili in acqua
fusione alcalina (Na2CO3), non importante per i beni culturali
digestione UV - con H2O2, per eliminare le sostanze organiche e battericide.
Campioni di riferimento standard- Hanno aggressioni di certa durata per concentrazioni note di unj certo soluto. Però può capitare anche che di diversi tipi del soluto, se ne sciolga uno solo o tutti insieme.
MICROSCOPIA OTTICA
Il microscopio permette di ingrandire un oggetto tramite un sistema di lenti (fino a 1000 ingradimenti).
Si possono analizzare tutte le tipologie di manufatti in ogni tipo di sezione; in più collegandolo con una camera fotografica si possono tirare fuori delle immagini.
Osservazioni a BASSO ingrandimento (10-40X)
osservazioni preliminari e d'insieme del campione
determinazione delle dimensioni del campione
acquisizione fotografica
operazioni di restauro
reazioni microanalitiche di riconoscimento di analiti
Osservazioni a FORTE ingrandimento (40-1000X)
osservazione di cross section
ILLUMINAZIONE CAMPIONE
luce trasmessa (attraverso il campione in spessori sottili)
luce riflessa (sulla superficie; più utilizzata, anche se la luminosità e il contrasto sono peggiori)
I tipi principali di microscopio ottico sono:
MICROSCOPIO STEREOSCOPICO - Due obiettivi inviano due distinte immagini a due oculari conferendo tridimensionalità all'oggetto osservato
MICROSCOPIO POLARIZZATORE- Particolare sistema di osservazione delle sezioni sottili per ottenere informazioni sulle fasi mineralogiche presenti in un campione
MICROSCOPIA ELETTRONICA A SCANSIONE
Il microscopio elettronico a scansione permette di ottenere immagini ad elevati ingrandimenti di un oggetto (200.000 volte), con un elevato potere di definizione.
Si possono analizzare campioni in sezione lucida trasversale, in pochissime quantità.
PREPARAZIONE DEL CAMPIONE- Il campione, tal quale o inglobato in una sezione lucida trasversale, viene metallizzato (per grafitura o doratura) per rendere conduttiva la sua superficie.
Analisi NON DISTRUTTIVA: una volta eliminata la metallizzazione per semplice abrasione, il campione può
essere sottoposto ad ulteriori analisi.
Contro- E' difficile riconoscere i componenti in bianco e nero; costi abbastanza alti.
Funzionamento: da una sorgente (da un filamento con della corrente) vengono degli elettroni che vengono emessi a fasci. I fasci emessi fanno una scansione delle aree selezionate dall'operatore che vengono rilevate da un sistema di rilevamento degli elettroni che tornano indietro; di questi elettroni che tornano indietro se ne distinguono due tipi, gli elettroni retro diffusi e gli elettroni secondari.
Gli elettroni secondari sono importanti perché rilevano le deviazioni che hanno ricevuto impattando con il campione, dando luogo a colorazioni più o meno scure o chiare (le immagini sono in b/n) a seconda di depressioni o picchi di rilievo sulla superficie esterna del campione. In sintesi danno informazioni su:
morfologia e stratigrafia del campione e del suo stato di degrado
presenza di biodeteriogeni e polline, spore, ecc., tenendo conto dell'ambiente di conservazione del manufatto
morfologia del particolato atmosferico
effetti di interventi di restauro (profondità della pulitura laser)
gli elettroni retro-diffusi penetrano nei primissimi strati atomici, e vengono contemporaneamente respinti dai gusci elettronici e attratti dai nuclei (di protoni), mantenendo la loro energia. Riemergono quindi con una traiettoria più o meno stretta a seconda del peso atomico degli atomi (pesanti = traiettorie più strette = segnale più intenso = zona più chiara. elementi LEGGERI = zone più scure). Rilevano:
presenza di composti differenti
distribuzione di elementi o fasi diverse
distribuzione dei metalli nelle leghe
03 -- DEGRADO DEI MATERIALI LAPIDEI
Noi studiamo il degrado dei materiali lapidei (pietra,marmi, malta, stucchi), perché sono i più presenti nel nostro territorio. Noi possiamo solo rallentare il degrado (frase di M. Yourcenar: l'uomo può rallentare questo processo di degrado verso ancora pietra). Il degrado è fisico e chimico.
DEGRADO FISICO- Interessa soprattutto la struttura dei materiali. Grandi cause:
Escursioni termiche- a furia di dilatarsi e contrarsi, il materiale continua a seguire questi movimenti; ma esiste un limite di elasticità dei materiali (questo fatto è particolarmente importante nel caso di materiali diversi che si muovono in modo diverso).
Idrometeore - L'acqua riesce a infiltrarsi nei pori del substato e, considerando le forme che assume l'acqua nell'atmosfera (pioggia, neve, ghiaccio, vapore) cambiando volume con la temperatura, causa pressioni di entità diversa sulle pareti interne dei pori.
Efflorescenze- L'acqua presente nel terreno riesce a risalire, per risalita capillare, fino nella struttura del materiale (muro, chiesa.); succede che poi l'acqua può evaporare, ma non i Sali minerali che essa portava con sé; a volte questi cambiano di composizione e di volume (a causa dell'idratazione) e quindi esercitano anche in questo caso pressioni più forti contro i pori della struttura che li ospita.
I Sali provengono dalla muratura, dal terreno, dall'atmosfera, dall'interazione con gli inquinanti gasosi (vedi degrado chimico). Inoltre i Sali possono essere solubili, parzialmente o insolubili, che sono i più pericolosi perché non sciogliendosi con l'acqua fanno aumentare ancora più il volume.
Nel caso di efflorescenze superficiali, il danno è solo esteriore (gesso fa macchie bianche-verdi), ma se queste sono all'interno della struttura (cripto-efflorescenze) possono creare gravi danni strutturali.
DEGRADO CHIMICO- Degli agenti inquinanti provenienti dall'atmosfera possono infiltrarsi e combinarsi coi Sali delle idrometeore, con la possibilità che si formino degli acidi, che aggrediscono il substrato.
Si possono formare acidi più ossidati (Sox, Co2 e Nox, quindi acidi solforici e non solforosi) perché nell'ambiente ci sono più elementi con alti numeri di ossidazione.
Questi acidi poi attaccano (reagiscono) con alcuni componenti del substrato, ovvero i carbonati, causando una loro solubilizzazione. CaCo3 → Ca++ + CO32- , perché viene dissociato causando con tante ripetizioni di questo processo, l'usura del materiale perché fai danni strutturali (crei dei vuoti che minano la stabilità della struttura) ed in più c'è acqua (per degrado fisico). La porosità del materiale aumenta, con aumento della sua vulnerabilità; questi particellari atmosferici catalizzano le reazioni di dissoluzione, col rischio di formare pure prodotti secondari (calcite ricristallizzata, gesso).
Tutto questo e i fenomeni già citati avvengono in sinergia: mira al degrado. Gli agenti principali, i METALLI PESANTI hanno alto peso atomico e la loro alta presenza è dovuta alle attività antropiche (platine rodio delle marmitte catalitiche) che intervenendo nel processo di degrado, fanno insorgere dei prodotti secondari o di neo-formazione. I principali sono:
ANIDRIDE SOLFOROSA O SOLFORICA
Origine: utilizzo di combustibili
Ruolo: fanno acido solforico che reagisce con il carbonato di calcio contenuto nelle rocce, formando gesso (calcio di-idrato). Nel caso di calcari dolomitici, si formano anche solfati di magnesio (esadriti e epsodriti).
Fenomeni di degrado: formazione di croste nere per l'inglobamento di particelle carboniose dello smog. Reazione: dissociazione H2SO4 → H22+ + SO4 2- che forma poi gesso mischiandosi con le rocce calcaree: CaSO4 . 2H2O (processo di solfatazione del substrato lapideo).
Dipende anche dal clima della regione (esadriti e epsodriti: MgSO4 . 6 o 7 H2O)
Dalla combustione di petrolio e carbone si libera nell'aria l'anidride solforosa (SO2), che si mischia con l'ossigeno dell'aria formando anidride solforica (SO3) e con l'acqua poi acido solforico (H2SO4), che è molto aggressivo. Infatti è molto corrosiva e trasforma le pietre calcaree in gesso, che con l'umidità si deteriora. Queste macchie si formano in genere sulle nicchie delle chiese, oggetti, nelle facciate nelle zone non esposte agli agenti atmosferici, e diventano delle croste, inizialmente bianche poi si sporcano e diventano scure. Infatti così sono meno esposte al dilavamento o al vento e le croste si possono insediare bene.
CaCO3 + H2SO4 + H2O → CaSO4 . 2H2O + CO2 = gesso
ANIDRIDE CARBONICA
Origine: atmosfera
Ruolo: forma acido carbonico che reagisce col carbonato di calcio del substrato forma bi-carbonato di calcio, che è molto solubile in acqua.
Degrado: in aree protette e con certe temperature il bicarbonato può formare efflorescenze o incrostazioni di carbonato di calcio ri-cristallizzato, perché il bicarbonato può ritornare carbonato di calcio, ma ormai la sua micro-struttura è cambiata rispetto all'originale, perciò non si legano più bene al marmo superficiale; quindi questo carbonato è di neo-formazione e sono anche più deboli (interazioni con forze Van der Wahl).
Reazioni: La Co2 dell'atmosfera si mischia con le piogge (che più acide sono, peggio è): CO2 + H2O, che poi reagisce con il carbonato di calcio, componente principale del marmo: + CaCO3 (insolubile)→ Ca(HCO3)2 , bicarbonato di calcio, solubile che quindi aumenta porosità della pietra o forma efflorescenze.
CaCO3 + CO2 + H2O Ca(HCO3)2 = bicarbonato di calcio
OSSIDI DI AZOTO E CLORURI
Ruolo: formazione di acidi che reagiscono col substrato formando nitrati, Sali molto solubili e quindi in grado di ri-cristallizzare con vari gradi di idratazione.
I cloruri vengono da bacini di acqua salata a causa del trasporto aereo.
Fenomeni di degrado: efflorescenze
Principalmente si creano composti di neo-formazione, come acido nitrico HNO3 e cloruri NaCl e KCl. Arrivano per deposito atmosferico (a volte per la semplice gravità), che possono essere attivi (reagiscono) o passivi, cioè non reagiscono, fan solo patine, ma in ogni caso provocano danni perché possono fare da substrato di base per agenti biodeteriogeni (muffe, funghi.).
In più a volte sono operazioni di restauro o pulitura precedenti, come usare pigmenti che poi si degradano in fosfo-proteine (latte, uovo) e si formano Patine e ossalato di calcio.
TIPOLOGIE DI DEGRADO- si dividono in 2 tipologie.
Senza peggioramento delle condizioni
ALTERAZIONE CROMATICA [chromatic alteration]Variazione naturale a carico dei componenti della pietra dei parametri che definiscono il colore. E' generalmente estesa a tutto il litotipo interessato; nel caso l'alterazione si manifesti in modo localizzato è preferibile utilizzare il termine macchia.
MACCHIA [staining, chromatic alteration]Pigmentazione localizzata della superficie correlata sia alla presenza di determinati componenti naturali del materiale (concentrazione di pirite nei marmi) sia alla presenza di materiale estraneo (acqua, prodotti di ossidazione di materiali metallici, sostanze organiche, vernici, graffiti urbani).
PATINA [patina]Modificazione naturale della superficie non collegabile a fenomeni di degrado e percepibile come una variazione del colore originario del materiale
PATINA BIOLOGICA [biological crust]Strato sottile, omogeneo, di colore variabile, costituito prevalentemente da microrganismi, variabile per consistenza, colore e adesione al substrato.
COLONIZZAZIONE BIOLOGICA [plants]Presenza di organismi vegetali sul substrato, riconoscibili macroscopicamente. Nel caso sia possibile una classificazione sistematica è preferibile utilizzare licheni , muschi , piante
Perdita di materiale
EROSIONE [surface erosion, surface reduction, roughening] Asportazione di materiale dalla superficie che nella maggior parte dei casi si presenta compatta.
EROSIONE DIFFERENZIALE [differential erosion]Evidenzia dell'eterogeneità dei motivi tessiturali o
strutturali tipici del materiale lapideo.
PITTING [pitting]Formazione di fori ciechi, numerosi e ravvicinati. I fori hanno forma tendenzialmente emisferica con diametro massimo di pochi millim
RIGONFIAMENTO [detachment]Sollevamento superficiale localizzato del materiale di forma
e consistenza variabili.
ALVEOLIZZAZIONE [alveolization, cavernous decay]Formazione di cavità di forma e dimensioni variabili, dette alveoli , spesso interconnesse e con distribuzione non uniforme. Nel caso in cui il fenomeno si sviluppi
essenzialmente in profondità con andamento a diverticoli si utilizza il termine alveolizzazione a cariatura.
PERDITA DELLA MORFOLOGIA DEL MANUFATTO
DISGREGAZIONE [disaggregation] Decoesione con caduta del materiale sotto forma di polvere
o minutissimi frammenti
ESFOLIAZIONE [exfoliation, contour scaling, flaking]Formazione di una o più porzioni laminari, di spessore molto ridotto e subparallele tra loro, dette sfoglie.
SCAGLIATURA [scaling, spalling]Distacco di parti di forma irregolare e spessore consistente e
non uniforme, dette scaglie, spesso in corrispondenza di soluzioni di continuità del materiale originario
DISTACCO [detachment] Soluzione di continuità tra strati superficiali del materiale (ad esempio un intonaco), sia tra loro che rispetto al substrato; prelude, in genere, alla caduta degli strati stessi. Nelle pietre le parti distaccate assumono spesso forme specifiche in funzione delle caratteristiche strutturali e tessiturali dando luogo a scagliatura, esfoliazione , crosta.
MANCANZA [loss]Perdita di elementi tridimensionali (braccio di una statua, ansa di un'anfora, brano di una decorazione a rilievo, ecc)
LACUNA [lacuna]Assenza di parti con sviluppo prevalentemente bidimensionale (parte di un intonaco e di un dipinto, porzione di impasto o di rivestimento ceramico, tessere di mosaico, ecc.).
DEPOSIZIONE E/O FORMAZIONE DI PRODOTTI SECONDARI
CONCREZIONE O INCROSTAZIONE [incrustation]Accrescimento compatto generalmente di estensione
limitata, sviluppato sia parallelamente sia perpendicolarmente alla superficie, in quest'ultimo caso può
assumere forma stalattitica o stalagmitica.
DEPOSITO SUPERFICIALE [dust, soot]Accumulo di materiali estranei di varia natura, quali polvere, terriccio, guano, ecc. Ha spessore variabile, generalmente scarsa coerenza e scarsa aderenza al materiale sottostante.
CROSTA [crust, gypsum skin, calcium sulphate skin]Modificazione dello strato superficiale del materiale lapideo. Di spessore variabile, generalmente dura, distinguibile dalle parti sottostanti per le caratteristiche morfologiche e, spesso,per il colore. Può distaccarsi anche spontaneamente dal substrato che, in genere, si presenta disgregato e/o polverulento.
EFFLORESCENZA [efflorescence, efflorescing salt]Formazione di sali, generalmente di colore biancastro e di
aspetto cristallino o polverulento o filamentoso, sulla superficie.
PELLICOLA [coating film, surface treatment]Strato superficiale di sostanze coerenti fra loro ed estranee
al materiale lapideo. Indipendentemente dalla natura o funzione (es.: pellicola pittorica di rifacimento, pellicola protettiva o con funzioni estetiche) essa deve poter essere identificabile come corpo estraneo che altera l'aspetto superficiale.
Riduzione della resistenza meccanica
DEFORMAZIONE [deformation, bowing]Variazione della sagoma o della forma che interessa l'intero
spessore del materiale.
RIGONFIAMENTO [detachment] Sollevamento superficiale localizzato del materiale di forma e consistenza variabili. Per (int.) si utilizza sollevamento
FRATTURAZIONE O FESSURAZIONE [cracking, splitting]Soluzione di continuità nel materiale che implica lo
spostamento reciproco delle parti
DIPINTI MURALI A FRESCO
SUPPORTO
Degrado fisico-meccanico
Danni strutturali
Distacco dell'intonaco dalla muratura
Degrado chimico
Infiltrazioni ed efflorescenze
Solfatazione della malta
FILM PITTORICO
I COMPOSTI estranei ai materiali originali provengono da:
degradazione dei pigmenti (per azione della luce e dell'umidità);
interazione tra pigmenti in miscela e tra pigmenti e leganti;
degradazione dei leganti organici (fotodecomposizione, degradazione ossidativa);
prodotti di passati interventi di conservazione e protezione superficiale e loro prodotti di degradazione;
STRATO PITTORICO
Degrado fisico-meccanico
Alterazione dell'adesione
Alterazione della coesione
Alterazione della planarità
Degrado chimico
Polverizzazione superficiale
Depositi superficiali (polveri, particellato)
Biodeterioramento
Attacchi di microrganismi
DIPINTI MURALI A SECCO
SUPERFICIE PITTORICA
Degrado fisico-meccanico
Perdita di adesione e distacco della pellicola pittorica
Degrado chimico
Alterazioni cromatiche
Alterazione della patina
DIPINTI SU TAVOLA
SUPPORTO
Degrado fisico-meccanico
Deformazioni
Fessurazioni e rotture, Scollamento delle tavole
Degrado chimico
Degradazione termica
Ossidazione
Biodeterioramento
Attacchi di insetti e di microrganismi
STRATI PREPARATORI-SUPERFICIE PITTORICA
Degrado fisico-meccanico
Alterazione della coesione e dell'adesione
Alterazione del rilievo e della planimetria
Degrado chimico
Decolorazione dei pigmenti
Alterazione di vecchi restauri e ridipinture
Alterazione degli oli e delle vernici
Svelature dovute a restauri inidonei
Alterazioni della doratura
Biodeterioramento
Attacco di microrganismi
DIPINTI SU TELA
SUPPORTO
Degrado fisico e meccanico
Deformazioni
Lacerazioni e strappi
Degrado chimico
Degradazione termica
Ossidazione
Biodeterioramento
Microrganismi e insetti
STRATI PREPARATORI-SUPERFICIE PITTORICA
Degrado fisico-meccanico
Alterazione dell'adesione e della coesione
Alterazione del rilievo e della planimetria
Alterazioni ottiche
Degrado chimico
Decolorazione dei pigmenti
Aumento della trasparenza
Alterazione di vecchi restauri e ridipinture
Alterazione degli oli e delle vernici
Svelature dovute a restauri inidonei
SCULTURE
DEGRADO FISICO-MECCANICO
Decoesioni, fessurazioni, fratturazioni
Esfoliazioni, scagliature, rigonfiamenti
Disgregazione e polverizzazione
Escursione termica
Inquinamento atmosferico
Effetti del lavoro di estrazione
Effetti della lavorazione
DEGRADO CHIMICO
Incrostazioni, concrezioni, pellicole
Efflorescenze
Corrosione ed erosione
Alterazioni cromatiche
Alterazioni della pellicola pittorica
BIODETERIORAMENTO
Attacco di microrganismi
CERAMICHE
Degrado fisico-meccanico
Difetti di fabbricazione
Fratturazioni, Fessurazioni
Distacco del rivestimento, dello smalto e di parti
Pulverulenza
Deformazioni
Consunzioni, Abrasioni, Danni da shock termico
Degrado chimico (interazione acqua/ materiale ceramico
Riargillificazione (il corpo ceramico tende a riassorbire
acqua con aumento di volume e forti pressioni sulla struttura
circostante)
Ricarbonatazione (l'anidride carbonica può interagire con
l'ossido di calcio formatosi durante la cottura e formare
carbonato di calcio)
Deposizione di sali
Incrostazione, Lisciviazione
Attacchi chimici (attacco dei silicati e dei carbonati)
Patine e macchie
MANUFATTI IN METALLO
DEGRADO FISICO-MECCANICO
Lacune, abrasioni
Fratture, distorsioni
Problemi di aggancio tra elementi
DEGRADO CHIMICO
Corrosione
Depositi superficiali, Pitting, Pulverulenza
Interventi di restauri inidonei STUCCHI
DEGRADO FISICO-MECCANICO
Rotture e fratture
Alterazione dei ferri di armatura
DEGRADO CHIMICO
Depositi superficiali e macchie
Ridipinture e scialbature
Alterazioni dello strato pittorico e della doratura
COMPOSTI estranei ai materiali originali
Gesso, solfati di magnesio
Efflorescenze
Prodotti di degrado dei leganti organici
MANUFATTI IN TESSUTO
DEGRADO FISICO E MECCANICO
Difetti di fabbricazione
Strappi, Consunzioni, Deformazioni
DEGRADO CHIMICO
Danni da umidità
Reazioni fotochimiche
Corrosione dei filati metallici
BIODETERIORAMENTO
Attacchi da insetti e microrganismi COMPOSTI estranei ai materiali originali
Prodotti di ossidazione della cellulosa
Prodotti di degrado di pigmenti e leganti
VETRO
perdita di brillantezza e trasparenza per il deposito di
prodotti di corrosione;
perdita del colore per la presenza di una rete finissima di
fratture con depositi di ossidi di manganese e ferro;
formazione di incrostazioni, deposito di polvere dovuta agli
inquinanti atmosferici (vetri esterni);
interventi conservativi errati e dalla conservazione in
ambienti non adatti della corrosione del vetro;
presenza di acqua: diffusione di molecole d'acqua,
conseguente migrazione sulla superficie di ioni alcalini e
raggrinzimento della superficie per diminuzione del volume
solubilizzazione del vetro
COMPOSTI estranei ai materiali originali
Gesso, solfati di magnesio
Efflorescenze
Prodotti di corrosione
MOSAICI
STRATI PREPARATORI
Degrado fisico-meccanico
Distacco o decoesione degli intonaci di sottofondo
MANTO MUSIVO
Degrado fisico-meccanico
Perdita di adesione
Deformazioni: sollevamento e spanciamento
Fratturazioni e fessurazioni
DEGRADO CHIMICO
Corrosione
Deposito di sali solubili
Opacizzazione della superficie delle tessere vitree
Efflorescenze
BIODETERIORAMENTO
Attacchi biologici e microbiologici
COMPOSTI estranei ai materiali originali
Gesso, solfati di magnesio
Efflorescenze
MATERIALE SCRITTORIO
COMPOSTI estranei ai materiali originali
prodotti di acidificazione della carta
prodotti di degrado dei leganti e dei trattamenti organici
DEGRADO CHIMICO
Acidificazione
Reazioni fotochimiche
Efflorescenze
BIODETERIORAMENTO
Attacchi biologici e microbiologici
MATERIALI LIGNEI
COMPOSTI estranei ai materiali originali
prodotti di degrado della lignina e della cellulosa
prodotti di degrado dei leganti e dei trattamenti organici
04- TECNICHE SPETTROSCOPICHE
RIASSUNTO -- Le tecniche spettroscopiche si basano sull'esame dello spettro caratteristico di ogni elemento, sfruttando l'interazione di una radiazione elettro-magnetica con la materia. Si distinguono in spettrometria di emissione, di assorbimento e di diffrazione.
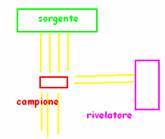
Lo spettrofotometro è un apparecchio costituito essenzialmente da una sorgente di radiazioni (ultraviolette, visibili o infrarosse), da un monocromatore a prisma (o reticolo) e da un rilevatore fotoelettrico di radiazioni. In particolare vengono usate lunghezze d'onda dell'infra-rosso perché molto utili ad individuare i composti.
Le radiazioni, a causa della loro bassa energia, non promuovono elettroni a livelli superiori, ma fanno solamente vibrare gli atomi all'interno delle molecole. A seconda degli atomi (e della qualità e della quantità dei legami) si ha un assorbimento di frequenze radianti infrarossi diverse e, quindi, un diverso spettro. Lo spettro IR nei confronti di una sostanza ha un ottimo valore diagnostico, superiore ad altri dati, come il punto di fusione, La densità e l'indice di rifrazione.
Le tecniche spettroscopiche si dividono in:
Spettroscopie molecolari (UV-vis, IR e Raman) - tecnica qualitativa e quantitativa
Spettroscopie atomiche (assorbimento ed emissione atomiche) - tecnica qualitativa
PRINCIPIO DI FUNZIONAMENTO- lo spettro completo è formato da 3 tipi di onde: ultra-violetto (200-400nm), visibile (400-700nm) e infra-rossi (700-4000 nm). Se faccio passare una quantità di onde (di tutti questi tipi) nel campione, le onde si infrangeranno contro la struttura interna del campione: in questo modo, parte delle onde verrà riflessa, parte assorbita, parte filtrerà dall'altra parte, o indenne o un po' diminuita d'intensità.
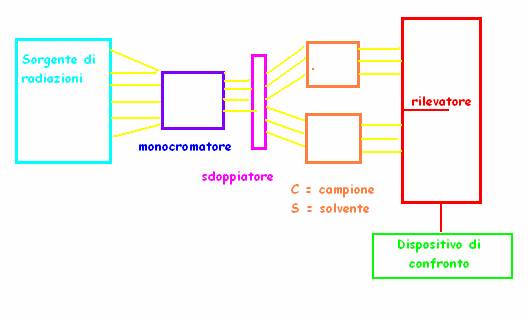 LO
STRUMENTO: LO SPETTROFOTOMETRO- E' lo
strumento che permette di registrare le differenze di radiazione tra quella emessa
in origine e quella filtrata. Esistono di due tipi, a raggio singolo e a doppio
raggio, ma quest'ultimo è molto più usato. Analizzando elemento per elemento:
LO
STRUMENTO: LO SPETTROFOTOMETRO- E' lo
strumento che permette di registrare le differenze di radiazione tra quella emessa
in origine e quella filtrata. Esistono di due tipi, a raggio singolo e a doppio
raggio, ma quest'ultimo è molto più usato. Analizzando elemento per elemento:
Sorgente = di solito costituita da due lampade che emettono spettri continui, una nel visibile (lampada a incandescenza) e una nell'UV (lampada ad idrogeno); è da essa partono le radiazioni.
Monocromatore = dispositivo (o a prisma o a reticolo di diffrazione) capace di selezionare con continuità solo la radiazione dell'intervallo di lunghezza d'onda che vogliamo arrivi al campione
Sdoppiatore del raggio = sistema ottico che permette di dividere il fascio di radiazioni in 2 perfettamente identici.
Celle = i due raggi arrivano a due celle di quarzo (usato perché trasparente alle radiazioni usate) separate, una contenente il campione disciolto (C), l'altra contenente il solvente (S).
Rilevatori = fotosensibili, permettono di misurare con precisione l'intensità della radiazione che ha superato il campione e il solvente
Dispositivo di confronto = confronta gli spettri sottraendo poi le interferenze del solvente.
 I fenomeni provocati nel
campione dall'assorbimento cambiano a seconda della lunghezza d'onda della
radiazione incidente, ma la quantità di radiazione assorbita in corrispondenza
delle diverse lunghezze d'onda dipende dai composti presenti nel campione.
L'assorbimento poi viene visualizzato tramite uno spettro, che sarà
caratteristico per ogni specie chimica, grazie al confronto con spettri
standard.
I fenomeni provocati nel
campione dall'assorbimento cambiano a seconda della lunghezza d'onda della
radiazione incidente, ma la quantità di radiazione assorbita in corrispondenza
delle diverse lunghezze d'onda dipende dai composti presenti nel campione.
L'assorbimento poi viene visualizzato tramite uno spettro, che sarà
caratteristico per ogni specie chimica, grazie al confronto con spettri
standard.
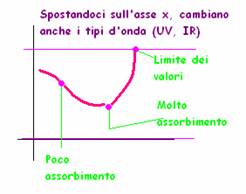
Ogni elemento ha uno spettro caratteristico perché assorbirà le diverse lunghezze d'onda in maniera peculiare. Sull'asse x il valore usato lo chiamiamo λ (radiazione originale) mentre su y riportiamo il valore della stessa onda in uscita.
L'unione di tutti i punti (valori misurati) forma una curva che ha picchi caratteristici per ogni elemento.
Noi misuriamo per convenzione il valore della radiazione trasmessa (che filtra) ma potremmo misurare quella assorbita; però è comunque facile ricavare l'altro valore, visto che il loro totale darà sempre la quantità di radiazione emessa dalla sorgente.
Come già detto, esistono due tipi in generale di analisi spettroscopiche
Tecniche molecolari: le radiazioni reagiscono con le molecole del campione
Informazioni qualitative e quantitative sui composti molecolari
Tecniche importanti: UV-vis, IR, Raman
Tecniche atomiche: le radiazioni reagiscono con gli atomi del campione solubilizzato
Informazioni qualitative sugli elementi
Assorbimento ed emissione atomica
TECNICHE SPETTROSCOPICHE MOLECOLARI Otteniamo informazioni soprattutto riguardo i gruppi funzionali che sono tipicamente caratteristici del livello molecolare; essi sono chimicamente, dei gruppi di atomi che caratterizzano le molecole conferendogli particolari proprietà. Esistono gruppi funzionali inorganici (carbonati, nitrati, fosfati) e organici (gruppo ossidrilico, carbossilico.).
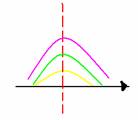 Gli elementi riconoscibili a
livello molecolare sono i gruppi funzionali perché si ripetono in modo
sempre uguale nella forma dei picchi e in punti precisi dello spettro, formando
combinazioni uniche per ogni tipo di sostanza (calce, gesso, malte);
infatti anche se cambio la radiazione iniziale λ , la forma del picco
rimane sempre invariata. Perciò per riconoscere una sostanza, basta riconoscere
uno o più picchi caratteristici per comprendere di che molecola ci stiamo
occupando.
Gli elementi riconoscibili a
livello molecolare sono i gruppi funzionali perché si ripetono in modo
sempre uguale nella forma dei picchi e in punti precisi dello spettro, formando
combinazioni uniche per ogni tipo di sostanza (calce, gesso, malte);
infatti anche se cambio la radiazione iniziale λ , la forma del picco
rimane sempre invariata. Perciò per riconoscere una sostanza, basta riconoscere
uno o più picchi caratteristici per comprendere di che molecola ci stiamo
occupando.
I picchi caratteristici si riconoscono soprattutto per 3 caratteristiche:
La forma dei picchi (informazione sul gruppo funzionale) (rotonda/sharp)
La lunghezza d'onda sulla quale si posizionano nel grafico (identifica il composto) (bande di riferimento: 424-873-712)
L'intensità relativa del picco (informazioni sulla quantità del composto)
SVANTAGGI- il problema è che tutte le molecole presenti nel campione reagiscono alle radiazioni coi loro gruppi funzionali, facendo registrare nel grafico tantissimi picchi che si confondono tutti insieme; le interferenze più frequenti sono:
Più specie chimiche esistono nel campione, più è difficile aver chiarezza e precisione
altre sostanze possono avere picchi caratteristici molto simili, come Ca e Mg.
Sostanze presenti in scarsa quantità possono non venire rilevate, in quanto causano variazioni minime dello spettro già tracciato da sostanze più massicciamente presenti.
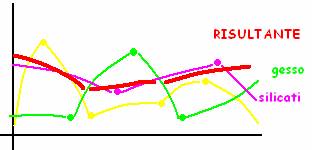 SOLUZIONE- fortunatamente, quando analizziamo un campione, abbiamo già
un'idea almeno vagamente di cosa troveremo nel campione, cioè quali sostanze.
Da questo punto possiamo osservare se nello spettro risultante sono
riconoscibili almeno in parte gli spettri caratteristici (standard) dei
composti che mi aspettavo di trovare. L'interpretazione umana delle curve è
sempre migliore di quella effettuata automaticamente dalle macchine, in quanto
tiene conto della non-coincidenza perfetta, parte dovuta a alterità chimiche
del tipo di composto, parte dovute alle interferenze più o meno massive di
altre sostanze (che l'umano può considerare).
SOLUZIONE- fortunatamente, quando analizziamo un campione, abbiamo già
un'idea almeno vagamente di cosa troveremo nel campione, cioè quali sostanze.
Da questo punto possiamo osservare se nello spettro risultante sono
riconoscibili almeno in parte gli spettri caratteristici (standard) dei
composti che mi aspettavo di trovare. L'interpretazione umana delle curve è
sempre migliore di quella effettuata automaticamente dalle macchine, in quanto
tiene conto della non-coincidenza perfetta, parte dovuta a alterità chimiche
del tipo di composto, parte dovute alle interferenze più o meno massive di
altre sostanze (che l'umano può considerare).
Dopo aver visto i principi generali, ora vediamo i tipi più diffusi di spettrometria molecolare.
SPETTROFOTOMETRIA MOLECOLARE UV-VISIBILE - E' pochissimo usata e l'accenniamo solamente perché è molto specifica e quantitativa. L'intervallo di radiazione incidente (= scelta col monocromatore), comprende UV lontano (10-200 nm), l'UV vicino (200-380) e il visibile (380-780), anche se a noi interessano più gli ultimi due.
 TRATTAMENTO DEL CAMPIONE- Si possono usare quantità minime di
campione, che però deve essere disciolto in soluzione ma parzialmente. Va
scelto un solvente che non provochi forti interferenze. Viene mantenuto in un
porta-campione apposito chiamato UVetta, che è aperto sul lato superiore e
inferiore per fare filtrare la radiazione. Le altre pareti sono di quarzo, che
non danno interferenze. Le altre pareti sono anche zigrinate per sapere dover
toccare l'UVetta con le mani senza inquinarne la superficie.
TRATTAMENTO DEL CAMPIONE- Si possono usare quantità minime di
campione, che però deve essere disciolto in soluzione ma parzialmente. Va
scelto un solvente che non provochi forti interferenze. Viene mantenuto in un
porta-campione apposito chiamato UVetta, che è aperto sul lato superiore e
inferiore per fare filtrare la radiazione. Le altre pareti sono di quarzo, che
non danno interferenze. Le altre pareti sono anche zigrinate per sapere dover
toccare l'UVetta con le mani senza inquinarne la superficie.
Ci dà informazioni:
Qualitative - ma non sono molto importanti visto il discorso già fatto della sovrapposizione (es: l'ocra gialla ha 3 picchi con bande larghe, che appunto essendo larghe si possono perdere nei picchi di altre sostanze)
Quantitative- (più importante) grazie alla legge di Lambert Beer, possiamo ricavare delle rette di taratura.
RETTE DI TARATURA- La legge di Lambert Beer ci permette di ricavare la diminuzione di intensità dopo il passaggio attraverso il campione rispetto alla intensità della radiazione incidente. Notiamo che la assorbanza è direttamente proporzionale alla costante data dalla concentrazione dell'analita.
![]() A = assorbanza (possiamo
calcolare la trasmittanza con l'equivalenza A = - log T, di trasmittanza = I /
I0 = radiazione trasmessa / radiazione incidente)
A = assorbanza (possiamo
calcolare la trasmittanza con l'equivalenza A = - log T, di trasmittanza = I /
I0 = radiazione trasmessa / radiazione incidente)
ε = coefficiente di estinzione molare (specifico per ogni sostanza)
b = cammino ottico (spessore del campione)
C = concentrazione
Grazie a questa legge posso anche costruire rette di taratura, con l'equivalenza analoga A = K e C, in cui l'assorbanza è direttamente proporzionale alla trasmittanza. Ovviamente però anche l'UV etta fa un minimo di interferenza, che infatti è considerata dalla costante K, che dipende dalla sostanza e dalla larghezza dell'UV etta, calcolata di solito in via empirica o usando delle rette di taratura.
Prendendo 4 soluzioni standard contenenti la stessa sostanza a concentrazione nota, ma l'una il doppio dell'altra (es: M1 = 0,1 conc, M2 = 0,2 conc). Se le misuro dovrei ottenere diretta proporzionalità tra assorbanza e riflettanza (sommandole otterrei la quantità iniziale), invece parte della radiazione si disperde a causa della seppur minima interferenza del campione. Mettendo insieme i dati ottenuti costruisco la retta di taratura che dovrebbe eliminare ogni influenza esterna nei risultati finali.
Spesso le rette di taratura si calcolano a mano perché tutte le misure analitiche sono suscettibili d'errore (per lo strumento, per la preparazione e per errori sperimentali).
LIBRO- E= log . I0/I = ε . d . c _____ E= estinzione, I0 = intensità radiazione incidente, I= radiazione trasmessa, d= spessore della cella che contiene il campione, ε= coefficiente di estinzione.
Nel complesso, la legge di Lambert Beer permette di correlare un dato spettrofotometrico sperimentale con la concentrazione di un analita.
SOSTANZE INDAGABILI
Il grande limite è dato dal fatto che per questa analisi si richiede quasi sempre la solubilizzazione della sostanza, il che è applicabile su pochi tipi di bene culturale, come:
Pigmenti organici, quindi utile per materiali tessili
Ioni metallici o molecolari (nitriti, nitrati e solfiti) nei materiali lapidei, prima però che si siano formati composti derivati che alterano la assorbanza del campione. Esistono comunque dei metodi molto più efficaci per i metalli.
Coloranti (soprattutto di materiali tessili e lacche), anche se devono subire diversi trattamenti (e quindi servono prelievi non piccoli)
Materiali incogniti- si possono legare alti campi di assorbimento a valori di concentramento alti
SPETTROSCOPIA INFRAROSSI- (FT-IR Viene usata molto ma come tecnica preliminare, dato che praticamente tutte le sostanze reagiscono ai raggi infrarossi, diversamente dalle lunghezze d'onda degli ultravioletti o dello spettro visibile. Lo usiamo quando e se non sappiamo quasi nulla del nostro campione, perché rileva sia sostanze organiche che inorganiche.
SPETTRO INCIDENTE- Di tutto il vasto spettro degli infrarossi, scegliamo col monocromatore solo l'intervallo interessante per i beni culturali, ovvero quello tra 700- 4000 nm.
TRASFORMATA DI FOURIER- E' un metodo che elabora il segnale tramite una complessa procedura matematica permettendo una sensibilità dello strumento molto maggiore; in questo modo riesce a captare anche segnali molto deboli. Per questo ormai sempre quando si parla di spettroscopia IR si dice Ft-IR.
Teniamo conto che ancora, il rapporto tra assorbanza e trasmittanza è: A= -log T
METODO DI ACQUISIZIONE- Ovvero come il campione viene indagato.
TRASMISSIONE- pastiglie di KBr o NaCl e celle di diamante
RIFLESSIONE - sezioni lucidi trasversali
RIFLETTANZA TOTALE ATTENUATA (ATR) - campione così com'è (fai solo analisi di superficie)
PASTIGLIE E CELLE DI DIAMANTE, LE PIU' USATE- In generale i porta-campioni sono molto diversi a seconda dello stato di aggregazione della materia. Vediamo i due metodi più usati:
PASTIGLIE = Nel caso del NaCl viene presa 1 pp di campione e 5 pp di sale e vengono pastigliate insieme da una macchina detta appunto pastigliatrice. Otteniamo così delle pastiglie trasparenti di 2-3 cm di diametro X 0,5 cm di spessore in cui il campione è immerso come in una matrice: i Sali scelti sono trasparenti al medio IR così che non danno nessuna interferenza. Così si eliminano le interferenze. Se ad esempio facessimo una pastiglia di solo campione, la trasmittanza sarebbe troppo bassa per avere dati accettabilmente precisi: diluendo il campione in una matrice invece, arriva più segnale perché c'è meno assorbanza.
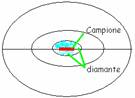 CELLA DI DIAMANTE- Sono 2 calotte semi-sferiche di materiale
trasparente di diametro 3-4cm. Al centro ci sono due facce piane di 0,5-1 cm e
dentro ancora, ci sono due faccine ancora più piccole di diamante; con un
microbisturi posizioniamo pochissimi granelli di campione tra le due facce.
Chiudendo la cella, il campione viene macinato tra le due facce. Lo scrigno
chiuso viene poi analizzato
CELLA DI DIAMANTE- Sono 2 calotte semi-sferiche di materiale
trasparente di diametro 3-4cm. Al centro ci sono due facce piane di 0,5-1 cm e
dentro ancora, ci sono due faccine ancora più piccole di diamante; con un
microbisturi posizioniamo pochissimi granelli di campione tra le due facce.
Chiudendo la cella, il campione viene macinato tra le due facce. Lo scrigno
chiuso viene poi analizzato
In questo modo c'è ancora meno concentrazione di campione, così che il segnale è ancora più forte vista la debole assorbanza del campione.
Si usano piccolissime quantità di campione; le pastiglie contengono circa 10-20mg di campione, mentre le celle possono utilizzare pochissimi granelli di un solo strato.
COMPOSTI INDAGABILI- Riusciamo a indagare moltissimi tipi di composti, anche i liquidi (leganti organici, lipidi e resine) che anche se sono meglio indagabili con altre tecniche (spettrometria di massa), è utile esaminarle con la spettroscopia Ft-IR perché ci permette di identificarli almeno genericamente (anche perché la spettroscopia è molto costosa e non sempre possibile quindi). Perciò per sapere almeno le classi dei composti dei leganti organici di un'opera, facciamo un'estrazione dall'opera con solventi organici (con un cotton-fiocc imbevuto di solvente che scioglie solo il legante), perché in genere la gran parte di un'opera è inorganica e quindi insolubile ai solventi organici che scegliamo. Ovviamente scegliamo un solvente (acetone, etere, benzene) che sia di polarità molto simile a quella del legante che voglio sciogliere (simile scioglie il simile): bisogna trovare il solvente adatto; posso anche riscaldare per accelerare la reazione. Per leganti diversi, è necessario ripetere ogni volta l'operazione coi solventi giusti.
Poi bisogna separare il legante dalla matrice di solvente: in genere basta il semplice deposito del non-disciolto. Il campione poi viene impastigliato col NaCl : per eliminare altre interferenze del solvente (che può esser rimasto in tracce), lo facciamo evaporare, visto che lo fa anche a basse temperature (a volte basta una temperatura ambiente di 20-25°C).
Purtroppo però, la spettroscopia con le pastiglie è distruttiva, perché così separi per sempre il legante e campione, che in più viene sciolto, e quindi proprio fisicamente distrutto.
Specchietto dei composti indagabili:
Organici: sostanze proteiche, oli, cere e resine, vernici, adesivi, leganti, molti pigmenti
Inorganici: carbonati, solfati, nitrati e in misura minore silicati. Sali inquinanti, materiali usati in restauro
TEMPI - Tecnica abbastanza veloce (un oretta) è utile se il restauratore ha bisogno di sapere subito quale è il legante. Per questo la spettroscopia si presta molto bene a molte analisi, pure organiche. IDENTIFICAZIONE- Ovviamente si identifica il composto tramite il confronto con spettri standard, desunti o da atlanti specializzati o da banche dati digitali, facendo un confronto rispettivamente a occhio (consideri le caratteristiche dei picchi) o automatico (il computer confronta automaticamente i picchi).
Nella storia dell'arte ci sono molti testi, anche antichi, che parlano della composizione e della preparazione dei leganti organici e dei pigmenti nelle diverse epoche. Questi dati sono molto utili, ma non tengono conto che nel corso del tempo, questi composti possono subire alterazioni chimiche, anche molto importanti. Bisogna tenere conto di questo costruendo delle banche dati. E' per questo motivo infatti, che stanno fiorendo gli esperimenti con campioni invecchiati artificialmente: i campioni vengono posti in camere con atmosfera controllata, dove vengono sottoposti a continui cicli di variazione di temperatura e umidità, vengono sottoposti a raggi UV, per aumentare l'invecchiamento. Simulando quello che nella realtà lo fa l'esposizione continua all'aria, quindi alle stagioni e agli agenti atmosferici. Di solito i provini sono parallelepipedi standard o vetrini con molti tipi di materiale lapideo, anche spalmati di leganti inorganici o altro (come metalli pesanti, cioè di di transizione, che sono molto catalizzatori nelle reazioni di degrado.
Precisiamo comunque che chi fa questi esperimenti sa perfettamente che le camere di invecchiamento non possono rendere le reali condizioni di invecchiamento naturale di un opera; per questo ci sono anche esperimenti di invecchiamento naturale, ma che ovviamente potranno dare risultati utili solo nel giro di molti secoli a venire.
TECNICA PRELIMINARE E ACCOPPIATA- L'approccio in chimica analitica è sempre multi-tecnico, anche perché così i diversi risultati si confermano a vicenda. Si usano sempre almeno due tecniche , anche se a volte riferendomi agli standard e a quello che sappiamo dell'opera, si possono datare con certezza.
In ogni caso, è importante dire che la spettroscopia IR, come già detto, è un'importante tecnica preliminare che permette di indagare una gran quantità di composti (pur con i suoi limiti), a costi relativamente bassi, permettendo di fare uno screening generale dei composti presenti nell'opera, da indagare poi in maniera più precisa con altre tecniche.
PRO E CONTRO- come già accennato:
PRO: costi abbastanza bassi, sensibilità, rapidità, semplicità (poche manipolazioni del campione) e versatilità, poco campione (intorno a 1mg)
CONTRO: poca selettività, interferenze (di conseguenza!), poca sensibilità per alcune classi di composti, analisi semi-quantitativa.
ANALISI SEMI-QUANTITATIVE- Sono effettuabili confrontando l'assorbimento di una sostanza registrato ad una lunghezza d'onda, con una curva di taratura "assorbimento-concentrazione" pre-determinata per la stessa sostanza. Il grado di precisione però è molto approssimativo.
MICROFT-IR ovvero la spettroscopia Ft-IR accoppiata col microscopio. Può analizzare pochissimi μm (5-10μm di irraggiamento) di campione selezionati col microscopio.
VANTAGGI: analisi non distruttiva dei campioni, analisi molto ordinate e selettive, analisi di stratigrafie (cross-section) in successione veloce ma soprattutto separatamente.
SVANTAGGI: molto costosa, interferenze
Riguardo quest'ultimo problema delle interferenze, ovviamente analizzando composti molto complessi, c'è una importante sovrapposizione di bande e di conseguenza difficoltà a interpretare gli spettri. Perciò vengono fatte delle estrazioni per limitare la varietà di composti con:
Celle di diamante: prelevi pochissimi granelli
Estrazione con solvente: usiamo per i composti organici acetone e etere, mentre per i composti inorganici l'acqua (nitrati, solfati.) (ma anche per alcuni organici, come la gomma arabica)
PROBLEMA DELL'AREA PICCOLISSIMA SELEZIONABILE- Possiamo certamente fare indagini precisissime (come strato per strato senza errori) ma più piccola è l'area d'indagine, più difficile è la ricerca.
Importante perché NON E' DISTRUTTIVA, perché basta passarle al microscopio.
Esempi:
Stele di Rosetta: aveva un aspetto lucido che si è perso perché la cera si è mischiata con le polveri (si è scoperto con quest'analisi)
Bande delle resine: alcune hanno spettri molto simili, a causa di gruppi funzionali uguali
Bande pigmenti moderni: molti sono sintetici ed è più complicato perché hanno bande molto dense
Esperimenti di invecchiamento artificiale: fino ai 200 anni fa, ora possiamo dare datazioni sicure.
SPETTROSCOPIA RAMAN- il nome viene dal fisico indiano che ha studiato questo fenomeno.
 Questo tipo di spettroscopia si basa sull'analisi delle
radiazioni che escono dal campione con un'angolatura di 90° rispetto alla
radiazione incidente: è un segnale meno intenso, ma che dà informazioni
importanti.
Questo tipo di spettroscopia si basa sull'analisi delle
radiazioni che escono dal campione con un'angolatura di 90° rispetto alla
radiazione incidente: è un segnale meno intenso, ma che dà informazioni
importanti.
Per questo motivo la sorgente è molto potente, intorno ai 500-700μm; per questo fino agli anni '70 era un'analisi pericolosa perché si utilizzavano raggi del visibile, mentre ora col laser il segnale è più forte di per sé, quindi non ci vuole un'intensità di raggi come prima.
La diffusione delle diverse lunghezze d'onda viene sempre calcolata come spettri d'intensità / λ (radiazione incidente).
Informazioni:
Permette di analizzare composti sia organici che inorganici.
Tecnica non distruttiva
Permette analisi in situ (è anche portatile): addirittura, i materiali scrittori (manoscritti e pergamene) sono indagabili direttamente (più è pregiato un'opera, meno è campionabile).
Campo d'indagine più ristretto dell'FTIR.
Bisogna usare campioni in sezioni lucide; il Raman è trasparente all'acqua (mentre l'IR l'assorbe, facendo bande fastidiose)
MATERIALI INDAGABILI:
Pigmenti minerali e organici in dipinti murali, miniature, pergamene, ceramiche, vetri
Inchiostri
Vetri
Fibre tessili
Prodotti da alterazione (pellicole o ossalato, biocolonizzazioni)
MICRO-RAMAN- Come per l'FTIR, è una spettroscopia Raman accoppiata con un microscopio: vale perciò lo stesso principio operativo, con gli stessi vantaggi e svantaggi:
Vantaggi: analisi non distruttiva, analisi di stratigrafie
Svantaggi: apparecchio costoso
SPETTROSCOPIE ATOMICHE
E' l'altro gruppo delle tecniche spettroscopiche: è più elementare, perché il suo principio è alla base anche delle tecniche molecolari:
la radiazione assorbita (o emessa) dal campione dipende in maniera univoca dagli elementi presenti nel campione precedentemente solubilizzato.
Si possono fare sia analisi quantitative che qualitative, basandosi su queste proprietà:
ANALISI QUANTITATIVA- la quantità di radiazione assorbita dipende dal numero di atomi di analita presenti nella soluzione (dalla sua concentrazione); ma è molto difficile da usare.
ANALISI QUALITATIVA- ogni tipo di atomo assorbe lunghezze d'onda diverse, facendosi individuare facilmente nello spettro mediante il riferimento agli standard.
SOLUBILIZZAZIONE E ATOMIZZAZIONE DEL CAMPIONE- Prima di venire utilizzato, un campione deve venire solubilizzato e quindi atomizzato.
COOP: STUDI DI PROVENIENZA- Le spettroscopie atomiche si prestano particolarmente bene agli studi di provenienza, ovvero lo studio delle varianti che uno stesso tipo di materiale subisce in diverse zone, dovute a varianti dei Sali, o di altre micro-sostanze che si trovano con essi in natura o come vengono lavorati (i marmi sono in natura di tipi diversi, mentre le ceramiche venivano lavorate insieme ad altri materiali nelle diverse città. La spettrometria si presta particolarmente bene a questi studi perché permette di confermare le variabili.
In genere però bisogna avere un'idea precisa degli elementi che voglio trovare perché si può fare l'analisi di un solo tipo alla volta.
SPETTROSCOPIA DI ASSORBIMENTO ATOMICO-
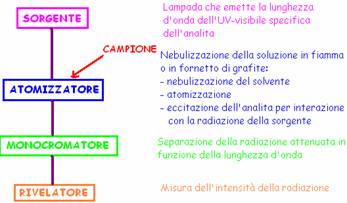 Consta di diverse fasi:
Consta di diverse fasi:
Solubilizzazione del campione
Atomizzazione ad elevate temperature; chiamato anche bruciatore, in cui bruciano acetilene e aria. Nella fiamma viene immessa la soluzione che si atomizza.
Irraggiamento con una radiazione specifica per l'analita (dell'UV-visibile)
Interazione radiazione-atomo (transizione degli elettroni esterni allo stato eccitato). Bisogna scegliere bene la lunghezza d'onda più adatta.
Assorbimento di radiazione
L'analisi quantitative è in teoria possibile misurando il rapporto tra la radiazione attenuata e la radiazione incidente in funzione della lunghezza d'onda permettendo così di costruire delle linee di taratura (per la legge di Lambert Beer) riguardo la concentrazione dell'analita, perché in teoria la radiazione assorbita (secondo la legge di Lambert Beer) dovrebbe essere direttamente proporzionale alla concentrazione del campione, con l'aiuto delle rette di taratura.
ELEMENTI INDAGABILI: si può fare praticamente con tutti gli elementi chimici che trova anche in tracce (ppm, ppb). Richiede studi precisi sulla determinazione degli elementi precisi, soprattutto in ambito mineralogico e inorganico, come metalli e pietre.
Devo più o meno sapere cosa devo indagare, perché si può analizzare un solo tipo di atomo alla volta
SPETTROSCOPIA DI EMISSIONE ATOMICA
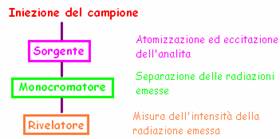 La solubilizzazione avviene
prima del processo vero e proprio, di solito con degli spray
La solubilizzazione avviene
prima del processo vero e proprio, di solito con degli spray
Il campione poi viene messo in un plasma (= massa di gas ionizzato ad altissime temperature) dove avviene l'Atomizzazione ed eccitazione degli elementi
Dopodiché, l'atomo emette delle radiazioni (specifiche per ogni analita) che vengono registrate dal rivelatore, che è sensibilissimo perché deve distinguere con chiarezza gli atomi.
Si possono anche qui fare analisi quantitative perché si costruiscono delle rete di taratura, create dal rapporto tra l'intensità della radiazione emessa e la lunghezza d'onda.
L'analisi quantitativa si basa sul idea che l'estinzione della luce incidente (=log Io/I) è proporzionale al numero di atomi della sostanza assorbente per unità di volume. Tuttavia questa linearità non è perfetta e vanno costruite delle rette di taratura.
I risultati trovati vengono messi su enormi tabelle con le concentrazioni dei singoli elementi o almeno i principali (almeno 20-30) che poi vanno elaborati i dati.
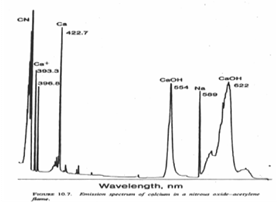
Questo è un esempio dell'assorbimento del calcio, in tutte le sue forme; possiamo notare che i picchi (molto sharp) si situano in lunghezze d'onda molto specifiche (indicati a volte con un numero addirittura!).
La scelta tra assorbimento o emissione atomica dipende da:
Tipo di analita
Concentrazione dell'analita
Matrice
06. ANALISI TERMICHE E GRAVIMETRICHE
ANALISI TERMOGRAVIMETRICA (TGA)
Principio di funzionamento: tramite la temperatura si può misurare la massa del campione; il procedimento pratico è sottoporre il campione ad un programma di riscaldamento in atmosfera controllata.
Riscaldamento = trasformazioni chimico-fisiche = assorbimento/cessione di energia = aumento/diminuzione di peso
Specie chimiche diverse reagiscono trasformandosi a temperature differenti ma caratteristiche (comunque tra i 900-1000°C, pur essendo la capacità del forno a 1500°C). Per questo motivo si possono riconoscere le specie chimiche presenti nel campione, anche se spesso si hanno delle aspettative.
Le trasformazioni che i campioni subiscono più spesso si volatilizzano in forma gassosa:
Perdita di H2O (gesso e ossalato di calcio) (Calce: CaSO4 . H2O, formando ossalato di calcio); avviene praticamente sempre a 100°C
 Perdita di CO e CO2 (ossalato di calcio, calcite, magnesite,
idromagnesite) (Carbonato di calcio: CaCO3 → CaO + CO2)
Perdita di CO e CO2 (ossalato di calcio, calcite, magnesite,
idromagnesite) (Carbonato di calcio: CaCO3 → CaO + CO2)
E' dunque una tecnica QUALITATIVA, ma ancora migliore come tecnica QUANTITATIVA : infatti mi dà una stima dell'elemento che si volatilizza.
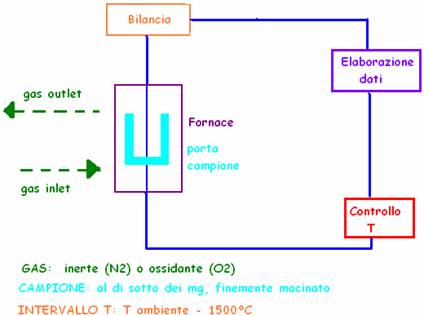
SCHEMA DELLO STRUMENTO:
Il campione deve essere macinato per rendere più chiara la temperatura superficiale specifica dell'elemento. Nella FORNACE di platino (resistente ad alte temperature) c'è un gas che esce e entra; può esser N2 che è inerte e serve solo a portare via i gas. Oppure si usa O che è un ossido e si può legare ai carboni: in questo modo si formano sì nuovi prodotti, ma che alla fine servono a calcolare il peso dell'elemento. La fornace è collegata ad una BILANCIA molto sensibile, il tutto collegato ad un ELABORATORE DI DATI che monitora peso e temperatura. Questo crea un grafico, detto TERMOGRAMMA, di cui facciamo un esempio.
ANALISI QUALITATIVA- si effettua analizzando i flessi del termogramma e poi confrontandoli con dei libri di riferimento per capire che analita sia. Bisogna interpretare bene i salti, ma purtroppo spesso gli analiti sono molteplici e si confondono e sovrappongono nel termogramma finale.
ANALISI QUANTITATIVA- A 100°C l'ossalato perde
H2O; perciò ad esempio, se prima il peso era 100%, ora è diminuito del 10%,
giungendo così a 90%. Conoscendo il peso totale (es: 100%= 10 mg), grazie alle
moli si 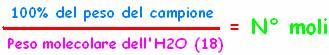 può
calcolare la concentrazione. Nel caso della calce, la quantità di H2O sarà
uguale a quella della calce stessa perché stanno in rapporto 1:1 (la sua
formula infatti è CaC2O4 . H2O). Ora che sappiamo la concentrazione in moli,
fai il processo inverso dividendo le moli per la concentrazione del campione:
(N°moli X peso molecolare CaC2O4 = peso) 0,5 mmol . 128 mg / mmol = 64 mg. Se
calcoli gli altri salti di massa, dovrei ottenere gli stessi risultati perché
calcoli in 2 modi diversi la stessa reazione (in genere l'analisi si fa su un
solo salto più accentuato e caratteristico).
può
calcolare la concentrazione. Nel caso della calce, la quantità di H2O sarà
uguale a quella della calce stessa perché stanno in rapporto 1:1 (la sua
formula infatti è CaC2O4 . H2O). Ora che sappiamo la concentrazione in moli,
fai il processo inverso dividendo le moli per la concentrazione del campione:
(N°moli X peso molecolare CaC2O4 = peso) 0,5 mmol . 128 mg / mmol = 64 mg. Se
calcoli gli altri salti di massa, dovrei ottenere gli stessi risultati perché
calcoli in 2 modi diversi la stessa reazione (in genere l'analisi si fa su un
solo salto più accentuato e caratteristico). 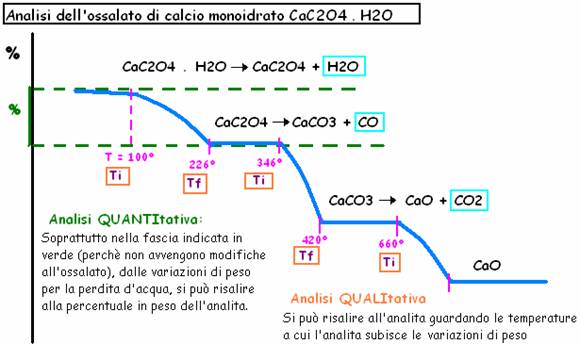
Vantaggi:
Velocità (un'analisi si completa facilmente in un'ora)
Sensibilità (le misure in peso sono tra le più precise)
Versatilità
Minima quantità e manipolazione del campione (poco campione per aver meno analiti presenti)
Svantaggi:
Scarsa selettività
Necessità di riferimenti standard (l'ossalato di calcio viene usato per tarare la bilancia)
Analisi strettamente quantitativa
Manufatti indagabili:
Malte (contenuto di legante come calcite, magnesite, dolomite). Hanno salti ben definiti.
Stucchi (contenuto dicalcite e gesso). Hanno grafici facilmente interpretabili e reagiscono con temperature molto alte
Prodotti di degrado (contenuto di gesso)
Pigmenti
Prodotti di restauro (polimeri)
Precisazione: Se dobbiamo calcolare la quantità di calcite delle malte, bisogna anche calcolare anche il gesso perché la calcite si trasforma in gesso; quindi bisogna fare un calcolo diretto e anche uno diretto.
TECNICHE CROMATOGRAFICHE
Eccellente tecnica sia qualitativa che quantitativa. Le tecniche cromatografiche sono tecniche di SEPARAZIONE: infatti permettono di separare e successivamente determinare gli analiti presenti in miscele anche complesse.
PRINCIPIO DI SEPARAZIONE: gli analiti si distribuiscono in due fasi, ovvero due parti assolutamente immiscibili tra loro e dunque separate, di solito per il loro diverso stato (solido, liquido, gassoso).
E' però efficiente solo per alcune classi di composti, perché altre specie si confondono perché si mischiano ad altre. Infatti gli analiti vengono a contatto con le 2 fasi e si possono ripartire (se le due Fasi sono liquide) o si adsorbono (quando una delle due fasi è solida) in maniera differenziata nelle 2 fasi a seconda della loro affinità (cioè solubilità) con esse. Infatti per separare efficacemente bisogna scegliere bene le 2 fasi, in modo da ottenerne una mobile che si staccherà più facilmente dall'altra, che invece rimarrà ferma. Per questo si distinguono una fase mobile (FM) e una fase stazionaria (FS).
 FASE STAZIONARIA (FS) = O è
solido o è un sottile film liquido stabile che ricopre la superficie interna
del contenitore (di silice) tiene unita e sigillata
FASE STAZIONARIA (FS) = O è
solido o è un sottile film liquido stabile che ricopre la superficie interna
del contenitore (di silice) tiene unita e sigillata
FASE MOBILE (FM) = Si trova all'interno del contenitore ed è liquido o gassoso e all'interno del contenitore riesce comunque a fare interscambi con l'esterno perché la FS non è completamente sigillante.
Nella tecnica, il contenitore è come una colonna, cavo sia sopra che sotto. La FM attraversa questo tubo (rivestito internamente di FS) attraverso un sistema di pompe.
Di solito il passaggio è più facile per un liquido che per un gas perché le molecole rimangono più compatte e vicine tra loro, quindi il passaggio tramite pompe è facilitato.
Nella colonna di FS mettiamo dentro l'analita con la FM; se predispongo bene la composizioni delle due fasi, mi aspetterò che l'analita dimostri più o meno affinità ionica con esse (cioè se ha simile struttura: polare, apolare, parzialmente polare). Valutando i due casi:
Se l'analita è simile alla FM → l'analita si lega alla FM ed esce velocemente
Se l'analita è simile alla FS → l'analita forma legami temporanei con la FS quindi rallenta la sua discesa
Soprattutto il secondo punto è importantissimo perché l'unico discrimine per distinguere gli analiti è il loro tempo di ritenzione all'interno della colonna. Di conseguenza, è una tecnica che dipende direttamente dalla struttura chimica dei vari agenti coinvolti, e bisogna anche considerare, all'interno dei macro gruppi di affinità, anche forze attrattive di minore entità (cioè sono tutti affini, ma comunque a diversi gradi); infatti composti molto simili potrebbero uscire dalla colonna ancora insieme. Per ovviare a ciò si può riscaldare il tutto, perché la temperatura fa differenziare nel comportamento composti anche molto simili.
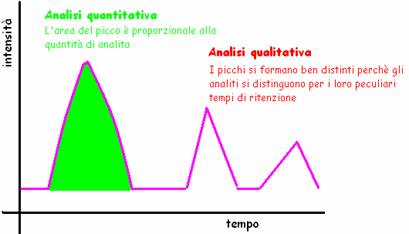 Alla fine
del loro percorso nella colonna, tutto ciò che ne esce (FM e analita) viene
registrato da un rilevatore, che registra in modo preciso i tempi dei vari
gruppi di composti, trasformando questi dati in un CROMATOGRAMMA, che registra
le uscite di materiale come picchi, più o meno ampi a seconda della loro
quantità. In teoria ogni picco dovrebbe corrispondere ad un analita, perché
dovrebbero rimanere tutti perfettamente isolati, se tutto il lavoro è stato
svolto con cura.
Alla fine
del loro percorso nella colonna, tutto ciò che ne esce (FM e analita) viene
registrato da un rilevatore, che registra in modo preciso i tempi dei vari
gruppi di composti, trasformando questi dati in un CROMATOGRAMMA, che registra
le uscite di materiale come picchi, più o meno ampi a seconda della loro
quantità. In teoria ogni picco dovrebbe corrispondere ad un analita, perché
dovrebbero rimanere tutti perfettamente isolati, se tutto il lavoro è stato
svolto con cura.
L'informazione QUANTITATIVA viene ricavata dall'area o dall'altezza del picco, perché sono proporzionali alla concentrazione dell'analita: A = k . C (non è la legge di Lambert Beer perché riguarda l'area!!), vale anche per l'altezza. Per preparare le rette di taratura, per ogni analita dispongo 4 soluzioni standard e con i risultati ottenuti costruisco una retta. C'è un programma che le costruisce automaticamente, ma questo procedimento va fatto elemento per elemento. Con più analiti posso fare le analisi per tutti questi elementi tutte insieme, basta solo conoscere le concentrazioni.
Precisazione: La linea del cromatogramma non segna mai d'intensità 0 perché comunque gli analiti scendono separati ma col flusso continuo di FM che fluisce continuamente.
GASCROMATOGRAFIA (GC)
Principio: FM gas (inerte, come elio e azoto) e FS solida o liquida. Il campione deve essere un gas o un liquido volatile. Se non lo è,il campione deve essere trasformato in un suo derivato liquido, noto e volatile (processo di derivatizzazione). Viene reso volatile con una sostanza disciolta insieme: si forma così una nuova specie chimica, in cui però posso distinguere gli analiti.
In queste condizioni le uniche sostanze indagabili sono quelle organiche (leganti pittorici, ma anche resine, cere, gomme vegetali.).
Parametri che ottimizzano la separazione:
Tipo di FS
Programma di temperatura a cui è sottoposta la FS
Svantaggi:
Pre-trattamento del campione
Numero elevato di campioni standard
Ci sono due modifiche di questa tecnica che permettono di aumentare la sensibilità della tecnica:
PIROLISI (PY-GC) Con questa analisi si può partire da sostanza anche solide, anche se non gassificabili o solubili (come polimeri reticolati come olii e resine); non faccio la derivatizzazione, ma la pirolisi = scaldare fino a 1000°C; così si ottiene un gas che viene immesso nella colonna. Questo metodo però va bene solo per le miscele più semplici, perché quelle complesse non sempre si sciolgono bene.
Purtroppo bisogna considerare che, oltre all'analisi di soli composti semplici, ha anche un costo elevato.
SPETTROMETRIA DI MASSA (GC-MS)
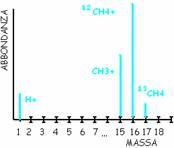 Principio:
si separano gli analiti grazie all'impatto con un fascio di elettroni, che
frammentano il campione, ma non in maniera casuale: infatti si ripartiscono tra
gruppi di molecole abbastanza caratteristici (per la loro carica). E', come
dire, una frammentazione caratteristica.
Principio:
si separano gli analiti grazie all'impatto con un fascio di elettroni, che
frammentano il campione, ma non in maniera casuale: infatti si ripartiscono tra
gruppi di molecole abbastanza caratteristici (per la loro carica). E', come
dire, una frammentazione caratteristica.
Esempio di analisi del metano: CH4 viene frammentato in CH4+ + CH3+ + H+ . Poi queste molecole caratteristiche vengono rintracciate singolarmente nel cromatogramma. Così possiamo confermare le nostre ipotesi sulla composizione del materiale in questione.
In più è meglio spendere qualche parola su
questo particolare cromatogramma, che viene sottoposto all'ANALISI
CHEMIOMETRICA. Le sostanze organiche sono più o meno proteiche o
lipidiche (posso rivelarlo con reazioni con composti ad hoc): in genere per
ogni campione ho in genere tutti e due i tipi di sostanza organica e li rilevo
inserendoli in un diagramma, che tiene conto anche dell'invecchiamento.  Con delle elaborazioni statistiche dell'analisi chemio metrica, io
posso rappresentare un campione con un punto; con molti campioni ottengo una
massa di puntini da cui posso trarre un'affidabile via di mezzo.
Con delle elaborazioni statistiche dell'analisi chemio metrica, io
posso rappresentare un campione con un punto; con molti campioni ottengo una
massa di puntini da cui posso trarre un'affidabile via di mezzo.
Da una parte però le cose si complicano perché si abbassa il limite di rivelabilità: nei leganti abbiamo concentrazioni bassissime di sostanza organica. In più c'è anche un altro problema sempre collegato all'analisi di sostanze organiche, cioè il loro invecchiamento; e quindi tenere conto anche delle rette di taratura adatte. Il problema è che infine, tutti questi accorgimenti alterano la validità dei risultati.
CROMATOGRAFIA LIQUIDA O LIQUIDA
Principio: ripartizione degli analiti, basata di solito sul principio dello scambio IONICO ("cromatografia ionica"), basata su una FM liquida (o solvente o miscela di solventi) e una fase stazionaria solida nella colonna.
Per trasportare il campione attraverso le colonne servono PRESSIONI ALTE: questo perché ci vuole forza per far passare la FM liquida attraverso la FS solida. Si parla quindi di "cromatografie liquide ad alta pressione" (HPLC=high pressure liquid chromathography)
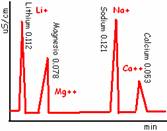 Campione: pochi mg ovviamente solubilizzati;
quelli utili all'analisi alla fine sono poche decine di μl.
Campione: pochi mg ovviamente solubilizzati;
quelli utili all'analisi alla fine sono poche decine di μl.
Applicazioni: analisi di Sali solubili (come efflorescenze) divisi in cationi e in anioni, spesso rintracciabili nei materiali lapidei. L'analisi della presenza e della quantità di cationi e anioni è fondamentale per valutare lo stato di degrado dei materiali lapidei. Infatti i Sali solubili sono fenomeni di degrado più frequenti delle malte e delle murature; possiamo anche analizzare efflorescenze e cripto efflorescenze.
Principali:
Cationi+: calcio, magnesio, sodio, potassio, ammonio
Anioni-: nitrati e nitriti, solfati, cloruri, fosfati
Il campione solubilizzato NaCl viene ionizzato in Na+ e Cl-. i campioni vengono macinati e aggiunti ad acqua de-ionizzata (acqua passata attraverso resine che trattengono ioni). Il grafico che poi risulterà al passaggio avrà in ascissa il tempo e in ordinata l'intensità, misurata in conducibilità.
Parametri che ottimizzano la separazione sono ovviamente il tipo di FS e FM scelti.
Vantaggi: Si presta bene all'automazione, perché il campione può venire iniettato con una siringa nel cilindro, evitando altre manipolazioni che potrebbero alterare in risultati.
Svantaggi: non è una tecnica di speciazione (troviamo sì solfati, ma sono di Ca o di Mg?), anche se posso cercare di combinare a logica anioni e cationi.
07. DIFFRAZIONE E TECNICHE SUPERFICIALI
DIFFRAZIONE DI RAGGI X (XRD)
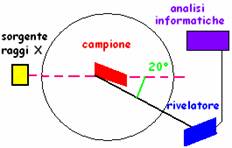 La
tecnica si basa sulla diffrazione di un fascio di raggi X focalizzato sul
campione. La lunghezza d'ordine della radiazione è dello stesso ordine di
grandezza delle distanze interatomiche: questo provoca FENOMENI DI DIFFRAZIONE,
che dipenderanno dal reticolo cristallino delle sostanza presenti.
La
tecnica si basa sulla diffrazione di un fascio di raggi X focalizzato sul
campione. La lunghezza d'ordine della radiazione è dello stesso ordine di
grandezza delle distanze interatomiche: questo provoca FENOMENI DI DIFFRAZIONE,
che dipenderanno dal reticolo cristallino delle sostanza presenti.
L'XRD permette il riconoscimento delle specie inorganiche cristalline presenti nel campione, tramite il confronto coi profili di diffrazione con standard di riferimento.
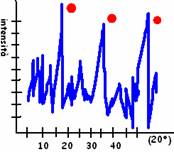 INFORMAZIONI:
analisi qualitativa (profilo di diffrazione) e quantitativa (intensità dei
picchi) degli analiti cristallini.
INFORMAZIONI:
analisi qualitativa (profilo di diffrazione) e quantitativa (intensità dei
picchi) degli analiti cristallini.
Composizione dello schema esempio: i picchi con i pallini rossi sono ossalato di calcio, ma anche sono riconoscibili gesso, calcite, silicati.
CAMPIONE: finemente macinato per evitare fenomeni d'interferenza.
APPLICAZIONI: Analisi di:
Malte (identificazione delle fasi di legante (calcite, dolomite) e aggregato (silicati)
Pigmenti
Materiali ceramici
Prodotti di degrado (efflorescenze, gesso)
TECNICHE SUPERFICIALI
Sono tecniche basate sull'interazione di una radiazione (raggi X o elettroni) con un materiale: le interazioni provocano l'emissione di raggi X. Il fenomeno interessa SOLO la superficie del materiale indagato e pertanto è una tecnica non-distruttiva.
QUALITATIVA- dipende dalla lunghezza d'onda emessa tipica di ogni elemento
QUANTITATIVA- dipende dall'intensità dell'onda legata alla loro concentrazione
La radiazione incidente:
Fascio di elettroni: spettroscopia di raggi X in dispersione di energia (EDX o microsonda)
Raggi X: fluorescenza di raggi X (XRF)
EDX O MICROSONDA
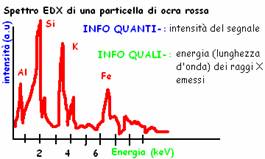 E' una
tecnica che di solito viene accoppiata col microscopio a scansione (SEM),
quindi si parla di SEM-EDX, microscopia elettronica con microsonda.
E' una
tecnica che di solito viene accoppiata col microscopio a scansione (SEM),
quindi si parla di SEM-EDX, microscopia elettronica con microsonda.
CAMPIONE: frammento o frazione lucida trasversale metallizzati (grafita tura, doratura)
PECULIARITA':
È possibile eseguire l'analisi elementare della stessa area (pochi μm2) visualizzata ed indagata tramite SEM
Una volta individuata la presenza di un elemento nell'area indagata, si può cercare di mappare la sua distribuzione (analizzando tante piccolissime aree).
Manufatti indagabili:
Materiali lapidei
Pitture
Metalli
Materiali tessili
Ceramiche
Vetri
Mosaici
FLUORESCENZA DI RAGGI X
Peculiarità: è possibile allestire un'apparecchiatura portatile per analisi in situ
Campione: frammento oppure polvere
Elementi identificabili: solo con elementi con numero Z superiore a 5.
Applicazioni:
Metalli
Pigmenti
Ceramiche
Materiali lapidei
Vetri e mosaici
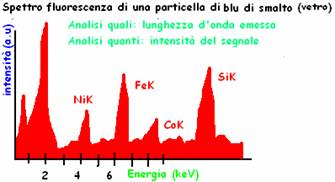 Analisi
di esempio di una particella di blu di smalto del vetro. Questo schema permette
di rilevare la presenza di alcuni elementi, in questo caso: Si, K, Ca, Co, As,
Fe, Ni e Bi.
Analisi
di esempio di una particella di blu di smalto del vetro. Questo schema permette
di rilevare la presenza di alcuni elementi, in questo caso: Si, K, Ca, Co, As,
Fe, Ni e Bi.
08. RIASSUNTO DELLE TECNICHE
MICROSCOPIA OTTICA
|
Indagine |
ingrandimento di oggetti tramite illuminazione e sistemi di lenti |
|
Informazioni |
Studio della morfologia e della stratigrafia |
|
Campo di applicazione |
Tutte le tipologie di manufatti |
|
Dimensioni e tipologia di campione |
Frammenti tali e quali e/o inglobati in sezioni trasversali lucide o sottili |
|
Sensibilità |
Fino a 1000 ingrandimenti |
|
Pro |
Le immagini mostrano chiaramente la morfologia e la stratigrafia dei campioni |
|
Contro |
Difficile riconoscimento dei componenti |
|
Costi |
Medio-bassi |
MICROSCOPIA ELETTRONICA A SCANSIONE
|
Indagine |
Ingrandimento di oggetti tramite interazione con un fascio di elettroni |
|
Informazioni |
Studio della morfologia e della stratigrafia |
|
Campo di applicazione |
Tutte le tipologie di manufatti |
|
Dimensioni e tipologia di campione |
Frammenti tali e quali e/o in sezioni trasversali lucide o metallizzate |
|
Sensibilità |
Fino a 200.000 ingrandimenti |
|
Pro |
Immagini ingrandite e tridimensionali della morfologia |
|
Contro |
Immagini in bianco e nero e difficoltà a riconoscere i componenti |
|
Costi |
Medio-alti |
Le tecniche spettroscopiche si basano sull'esame dello spettro caratteristico di ogni elemento, sfruttando l'interazione di una radiazione elettro-magnetica con la materia. Si distinguono in spettrometria di emissione, di assorbimento e di diffrazione.
Lo spettrofotometro è un apparecchio costituito essenzialmente da una sorgente di radiazioni (ultraviolette, visibili o infrarosse), da un monocromatore a prisma (o reticolo) e da un rilevatore fotoelettrico di radiazioni. In particolare vengono usate lunghezze d'onda dell'infra-rosso perché molto utili ad individuare i composti.
Le radiazioni, a causa della loro bassa energia, non promuovono elettroni a livelli superiori, ma fanno solamente vibrare gli atomi all'interno delle molecole. A seconda degli atomi (e della qualità e della quantità dei legami) si ha un assorbimento di frequenze radianti infrarossi diverse e, quindi, un diverso spettro. Lo spettro IR nei confronti di una sostanza ha un ottimo valore diagnostico, superiore ad altri dati, come il punto di fusione, La densità e l'indice di rifrazione.
Le tecniche spettroscopiche si dividono in:
Spettroscopie molecolari (UV-vis, IR e Raman) - tecnica qualitativa e quantitativa
Spettroscopie atomiche (assorbimento ed emissione atomiche) - tecnica qualitativa
SPETTROSCOPIA UV-VISIBILE
|
Indagine |
Correlazione tra la radiazione incidente e quella assorbita |
|
Informazioni |
Analisi qualitativa e quantitativa di composti organici e ioni metallici complessati |
|
Campo di applicazione |
Materiali tessili, pigmenti organici |
|
Dimensioni e tipologia di campione |
Frammenti di materiale solubilizzati |
|
Sensibilità |
Inferiore alle ppm |
|
Pro |
Apparecchiatura semplice (anche portatile) |
|
Contro |
Pre-trattamento del campione; difficile analisi qualitativa; sovrapposizione di bande |
|
Costi |
Medi |
SPETTROSCOPIA Ft-IR
|
Indagine |
Correlazione tra radiazione incidente e quella assorbita |
|
Informazioni |
Analisi qualitativa e semi-quantitativa di composti organici ed inorganici |
|
Campo di applicazione |
Tutte le tipologie di manufatti e di fenomeni di degrado |
|
Dimensioni e tipologia di campione |
Mg/μg di campione macinato, scaglie di campione, sezioni lucide, gocce di soluzione |
|
Sensibilità |
Mediamente sensibile |
|
Pro |
Versatilità, facili indagini preliminari, tecnica poco invasiva |
|
Contro |
Analisi quantitativa difficile, poca sensibilità per alcuni tipi di composti, sovrapposizione di bande |
|
Costi |
Medi |
SPETTROSCOPIA RAMAN
|
Indagine |
Correlazione tra radiazione incidente e radiazione assorbita |
|
Informazioni |
Analisi qualitativa di composti organici ed inorganici |
|
Campo di applicazione |
Pigmenti (affreschi, materiale scrittorio), vetri, ceramiche, inchiostri, prodotti di degrado |
|
Dimensioni e tipologia di campione |
Frammenti di campione tal quali e/o inglobati in sezione |
|
Sensibilità |
Media |
|
Pro |
Applicabilità in situ, semplicità, non distruttibilità, complementarietà con l'IR |
|
Contro |
Debole intensità dei segnali, allineamento elaborato della sorgente |
|
Costi |
Medi |
SPETTROSCOPIA DI ASSORBIMENTO ATOMICO
|
Indagine |
Misura dell'assorbimento di radiazioni da parte degli atomi |
|
Informazioni |
Analisi elementare (provenienza e datazione) |
|
Campo di applicazione |
Manufatti che possono essere disciolti |
|
Dimensioni e tipologia di campione |
Mg o nanog di materiale disciolto in ambiente acquoso |
|
Sensibilità |
Analisi di elementi in tracce |
|
Pro |
Ottimo rapporto costi / sensibilità |
|
Contro |
Pre-trattamento del campione; analisi quantitativa; nessuna identificazione dei composti che gli elementi formano insieme; analisi di un elemento per volta |
|
Costi |
Medio |
SPETTROSCOPIA DI EMISSIONE ATOMICA
|
Indagine |
Misura dell'emissione di radiazioni da parte degli atomi |
|
Informazioni |
Analisi elementare (provenienza, datazione) |
|
Campo di applicazione |
Manufatti che possono essere disciolti |
|
Dimensioni e tipologia di campione |
Mg / μg di materiale disciolto in ambiente acquoso |
|
Sensibilità |
Analisi di elementi in tracce (ppb) |
|
Pro |
Ottimo rapporto costi/sensibilità, analisi multi-elementare |
|
Contro |
Pretrattamento del campione, difficile analisi quantitativa, nessuna speciazione, più interferenze rispetto all'AAS |
|
Costi |
Medio-alto |
ANALISI TERMOGRAVIMETRICA
|
Indagine |
Misura della variazione di massa di un campione all'aumentare della temperatura |
|
Informazioni |
Analisi distruttiva quali- e quantitativa di composti inorganici |
|
Campo di applicazione |
Malte e stucchi; pigmenti che subiscono variazioni con il riscaldamento |
|
Dimensioni e tipologia di campione |
Al di sotto dei mg di campione macinato |
|
Sensibilità |
Ppm |
|
Pro |
Tecnica veloce, sensibile, versatile; minima quantità e manipolazione del campione |
|
Contro |
Scarsa selettività, necessità di riferimenti standard, analisi quantitativa. |
|
Costi |
Medio- alto |
GAS CROMATOGRAFIA GC/PY - GC/GC - MS/
|
Indagine |
Separazione e determinazione di una miscela di analiti, attraverso la ripartizione tra due fasi |
|
Informazioni |
Separazione ed analisi distruttiva quali- e quantitativa di miscele di composti organici |
|
Campo di applicazione |
Composti organici (leganti pittorici) |
|
Dimensioni e tipologia di campione |
Al di sotto dei mg di campione sottoposto a derivatizzazione |
|
Sensibilità |
Ppb |
|
Pro |
Tecnica sensibile; minima quantità di campione; separazione di miscele anche abbastanza complesse |
|
Contro |
Elevata manipolazione del campione; necessità di riferimenti standard |
|
Costi |
Medio-alti |
CROMATOGRAFIA LIQUIDA -HPLC- IC
|
Indagine |
Separazione e determinazione di una miscela di analiti, attraverso la ripartizione tra due fasi |
|
Informazioni |
Analisi distruttiva quali- e quantitativa di Sali inorganici |
|
Campo di applicazione |
Materiali lapidei (analisi del contenuto di Sali solubili) |
|
Dimensioni e tipologia di campione |
Decine di mg di campione sottoposto a solubilizzazione in acqua |
|
Sensibilità |
Ppm- ppb |
|
Pro |
Identificazione precisa degli analiti |
|
Contro |
Necessità di estrazione del campione |
|
Costi |
Medio-alti |
MICRO SONDA ELETTRONICA (EDX)
|
Indagine |
Raggi X emessi dalla superficie dopo l'interazione con un fascio di elettroni |
|
Informazioni |
Analisi qualitativa e quantitativa di elementi (Z≥5)in materiali inorganici; mappe di distribuzione |
|
Campo di applicazione |
Qualsiasi campione solido |
|
Dimensioni e tipologia di campione |
Frammenti o sezioni lucide trasversali metallizzate |
|
Sensibilità |
Fino a 0,05% in massa |
|
Pro |
Accoppiamento con SEM; stime quantitative degli elementi; analisi elementare di singole particelle |
|
Contro |
Analisi limitata alla superficie e ai composti inorganici |
|
Costi |
Medio-alti |
FLUORESCENZA DI RAGGI X (XRF)
|
Indagine |
Radiazione emessa dalla superficie dopo l'interazione coi raggi X |
|
Informazioni |
Analisi qualitativa e semi-quantitativa di elementi (Z≥5) |
|
Campo di applicazione |
Materiali lapidei, policromie, ceramiche, vetri, pitture murali, dipinti |
|
Dimensioni e tipologia di campione |
Frammenti |
|
Sensibilità |
Fino a 0,01% in massa |
|
Pro |
Stime quantitative degli elementi; rapidità; strumentazione portatile |
|
Contro |
Tecnica superficiale; bassa sensibilità, problemi di sicurezza, nessuna speciazione, interferenza della matrice |
|
Costi |
Medio-alti |
|
spettroscopia uv-vis: |
sciolto + uvetta; |
|
Spettroscopia infrared |
Macinato + pastiglie / cella diamante |
|
Spettroscopia raman |
Sezioni lucide |
|
Assorbimento atomico |
Solubilizzato e atomizzato |
|
Emissione atomica |
" " " " |
|
Termogravimentria |
Cosi com'è |
|
Gascromatografia |
Volatizzato |
|
Cromatografia liquida |
Solubilizzato |
|
Diffrazione raggi x |
Com'è |
|
Edx microsonda |
Com'è |
|
termofluorescenza |
|
|
spettroscopia uv-vis: |
mat solubili: pigmenti organici, ioni metallici, fibre tessili, coloranti materiali incogniti |
|
Spettroscopia infrared |
Praticamente tutto (tranne gessi e stucchi) |
|
Speetroscopia raman |
Pigmenti organici, fibre tessili, carta, inchiostri |
|
Assorbiemnto atomico |
Ogni cs solubizzabile |
|
Emissione atomica |
" " " " |
|
Termograviemtria |
Malte; stucchi; prodotti di degrado; di restauro; pigmenti - |
|
gascromatografia |
Solo organiche |
|
Cromatografia liquida |
Sali solubili |
|
Diffrazione raggi x |
Malte, prodotti degrado, ceramiche, pigmenti - |
|
Edx |
|
|
Fluorescenza |
Metalli pigmenti ceraiche lapidei, vetri mosaici |
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2024