|
|
| |
FORMULA BRUTA: è la formula che indica il numero di atomi di ciascuna specie presente nella molecola. Esempio: C2H4
Il vastissimo campo dei composti organici è organizzato mediante l'introduzione di classi. Tutti i composti che appartengono a una certa determinata classe sono caratterizzati dalla presenza di un gruppo di atomi che si chiama gruppo funzionale il quale rappresenta il centro della reattività chimica della molecola.
Idrocarburi con legami semplici, struttura tetraedrica, costituiti da atomi di carbonio ibridizzati sp3. Essi sono caratterizzati da formula bruta: CnH2n+2
La loro nomenclatura è semplice: il nome è costituito da un prefisso che indica il numero di atomi di carbonio seguita dalla desinenza -ano
|
Numero di atomi C |
PREFISSO |
|
|
Meta |
|
|
Eta |
|
|
Propa |
|
|
Buta |
|
|
Penta |
|
|
Esa |
|
|
Epta |
|
|
Otta |
|
|
Nona |
|
|
Deca |
|
|
Undeca |
|
|
Dodeca |
|
|
Trideca |
|
|
Tetradeca |
Vediamo qualche esempio:
|
Formula Bruta |
Formula di Struttura |
Nome |
|
CH4 |
CH4 |
Metano |
|
C2H6 |
CH3-CH3 |
Etano |
|
C3H8 |
CH3-CH2-CH3 |
Propano |
|
C4H10 |
CH3- CH2-CH2-CH3 |
Butano |
|
C5H12 |
CH3-CH2-CH2-CH2-CH3 |
Pentano |
Bisogna ricordarsi che ogni carbonio deve formare sempre 4 legami.
ISOMERI DI STRUTTURA: sono molecole con uguale formula bruta ma diversa formula di struttura, cioè posizione relativa degli atomi di C.
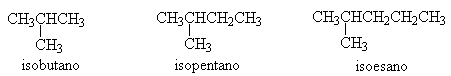
Tutti gli isoalcani possiedono un alchile in catena laterale legato al secondo carbonio della catena normale.
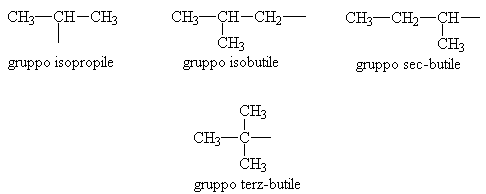
I gruppi che derivano dagli idrocarburi saturi per distacco di un idrogeno sono detti GRUPPI ALCHILICI ( R ) e la loro desinenza caratteristica è -ile.
|
Formula di Struttura |
Nome |
|
CH3- |
Metile |
|
CH3-CH2- |
Etile |
|
CH3-CH2-CH2- |
Propile |
|
CH3- CH2-CH2-CH2- |
Butile |
E' possibile ottenere gruppi alchilici diversi a seconda dell'atomo di idrogeno che si stacca.
Esempi sono i gruppi isopropile, isobutile, sec-butile, terz-butile tutti isomeri di struttura.
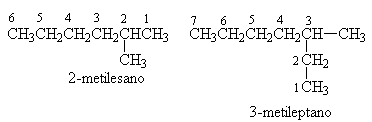
Gli idrocarburi possono essere a CATENA LINEARE o RAMIFICATA. Il gruppo o la catena che 757i89h
" pende" prende il nome di SOSTITUENTE.
ESEMPIO:
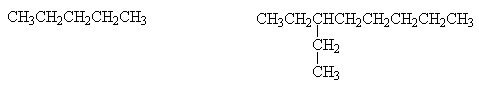
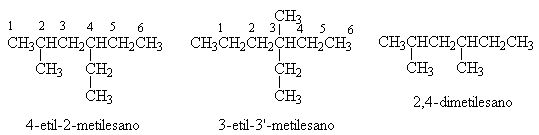
La nomenclatura degli alcani a catena ramificata obbedisce alle seguenti regole:
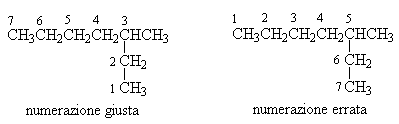
Molecole in cui un sostituente è un alogeno (F,Cl,Br,I).
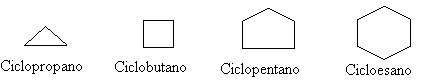
Gli idrocarburi insaturi possono anche presentarsi in forma ciclica e prendere il nome di cicloalcani. Questi costituiscono una serie omologa in quanto ciascun membro differisce da quello immediatamente precedente per un gruppo CH2 presente nella sua molecola. I composti semplici hanno la formula bruta CnH2n
Per eliminare ogni tensione angolare nel cicloesano i carboni ibridizzati sp3 si dispongono in una conformazione non piana di angoli 109,5° eliminando perciò ogni tensione angolare. Tale conformazione viene detta a sedia :
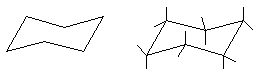
In questa conformazione a sedia ci sono due tipi di atomi di idrogeno: sei atomi di idrogeno sono proiettati verso l'esterno dell'anello (posizione equatoriale) mentre sei atomi sono diretti verticalmente ed alternativamente orientati verso l'alto o verso il basso (posizione assiale). In questo modo sono rese minime le repulsioni di van der Waals tra le nubi elettroniche degli idrogeni adiacenti. Il 99% delle molecole di cicloesano si trova nella conformazione a sedia che è la conformazione più stabile. Per un cicloalcano monosostituito (es: il metilcicloesano) si possono avere due distinte conformazioni a sedia; in una conformazione il metile occupa una posizione assiale nell'altra occupa una posizione equatoriale. Le due conformazioni sono interconvertibile mediante un semplice ribaltamento attraverso la conformazione a twist (che qui non riporteremo). E' da notare che con il ribaltamento conformazionale avviene lo scambio tra legami assiali ed equatoriali.
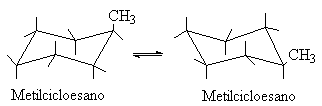
La conformazione del cicloesano monosostituito più stabile è quella in cui il sostituente è in posizione equatoriale.
Quando abbiamo la presenza di un cicloalcano disostituito introduciamo l'esistenza di stereoisomeri cis-trans. Se i sostituenti si trovano dalla stessa parte si parla di isomero cis, se sono da parti opposte si parla di isomero trans.
Con il termine stereoisomeri e quindi (stereoisomeria) si intende molecole che differiscono unicamente per la disposizione degli atomi nello spazio (hanno stessa formula bruta e stesso modo di legare gli atomi). Gli isomeri di struttura invece sono isomeri che differiscono tra loro perchè gli atomi sono legati in modo differente pur avendo la stessa formula bruta.
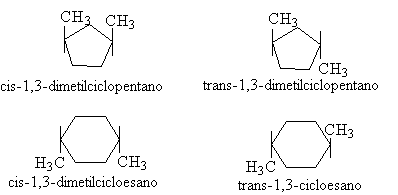
Se consideriamo le conformazioni reali a sedia del cicloesano abbiamo il seguente esempio con il trans-1,4 dimetilcicloesano.

Sono degli idrocarburi insaturi caratterizzati da legami doppi con atomi di carbonio ibridizzati sp2. Essi sono caratterizzati da formula bruta: CnH2n.
|
Formula di Struttura |
Nome |
|
CH2=CH2 |
Etene |
|
CH3-CH=CH2 |
Propene |
|
CH3-CH2-CH=CH2 |
1-Butene |
|
CH3-CH2-CH2-CH=CH2 |
1-Pentene |
La loro nomenclatura è semplice:
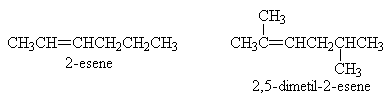

L'isomero cis ha i sostituenti dalla stessa parte, mentre l'isomero trans ha i sostituenti l'uno opposto all'altro.
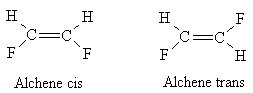
La stereochimica degli alcheni più sostituiti è difficile da stabilire. La nuova nomenclatura detta E, Z adotta la regola della priorità. Se i gruppi a più alta priorità si trovano dalla stessa parte del piano si ha una struttura E, mentre se si trovano dalla parte opposta si ha una struttura Z.

La priorità dei gruppi per questa regola di nomenclatura dipende dal numero atomico: maggiore è quest'ultimo, maggiore sarà la priorità dei gruppi.
Br > Cl > O > N > C > H
A priorità di numero atomico, si vede l'atomo successivamente legato: es. il gruppo etile ha priorità sul metile.
Sono idrocarburi insaturi caratterizzati da legami tripli con atomi di carbonio ibridizzati sp. Essi sono caratterizzati da formula bruta: CnH2n-2..
La loro nomenclatura è semplice: il nome è costituito da un prefisso che indica il numero di atomi di carbonio della catena più lunga contenente il triplo legame seguita dalla desinenza -ino
|
Formula di Struttura |
Nome |
|
CH CH |
Etino o acetilene |
|
CH3-C CH |
Propino |
|
CH3-CH2-C CH |
1-Butino |
|
CH3-CH2-CH2-C CH |
1-Pentino |
Per il resto valgono le stesse regole di nomenclatura adottate per gli alcani e gli alcheni.
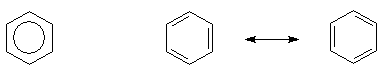
Particolare classe di composti in cui il capostipite è il BENZENE. Nel 1865 Kekulè propose la sua struttura ciclica esagonale in cui i sei atomi di carbonio costituiscono un anello e sono legati l'uno all'altro mediante un sistema di legami semplici e doppi che si alternano.
Per la nomenclatura dei derivati benzenici monosostituiti il loro nome è individuato indicando il gruppo sostituente e poi la desinenza benzene, nell'altro sistema tutto l'anello benzenico monosostituito è individuato da un nome specifico.
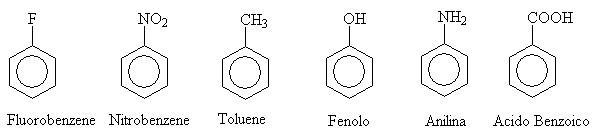
Quando l'anello benzenico porta due sostituenti, la loro posizione relativa è precisata mediante i prefissi orto, meta e para.

Anche nel caso dei derivati benzenici, vale la regola che i sostituenti devono avere i numeri più bassi possibile ed essere elencati in ordine alfabetico.
Il benzene può essere anche un gruppo sostituente. In questo caso è chiamato fenile ( C6H5- ).
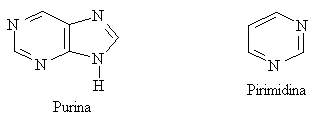
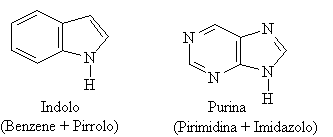
Alcuni composti aromatici sono eterociclici cioè hanno nella struttura ciclica atomi differenti dal carbonio come: S, N, O, ecc. I più comuni sono:
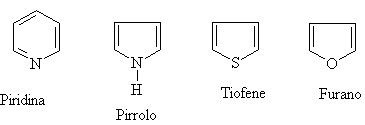
I sistemi eterociclici sono presenti in molti sistemi biochimici. I derivati della purina e della pirimidina sono i costituenti fondamentali del DNA e dell'RNA.
Le regole di nomenclatura sono uguali a quelle già discusse per i composti precedenti:
|
Formula di Struttura |
Nome |
|
CH3OH |
Metanolo (alcol Metilico) |
|
CH3CH2OH |
Etanolo (alcol Etilico) |
|
CH3-CH2CH2OH |
1-Propanolo (alcol Propilico) |
|
CH3-CH2-CH2-CH2OH |
1-Butanolo (alcol Butilico) |
ESEMPI:
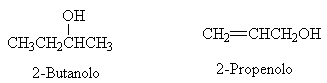
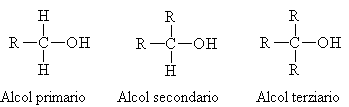
Gli alcoli si dividono in: primari, secondari, terziari a seconda di quanti sono i gruppi alchilici presenti sul carbonio a cui è legato il gruppo ossidrilico
Gli alcoli in cui sono presenti due gruppi ossidrilici sono detti dioli ( oppure glicoli).
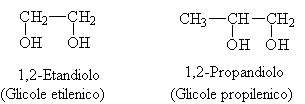
Se sono presenti tre gruppi ossidrilici sono detti trioli.
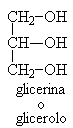
I fenoli sono composti aromatici caratterizzati dalla presenza del gruppo -OH legato direttamente ad un anello benzenico. Molti di questi composti essendo conosciuti in natura hanno dei nomi comuni.
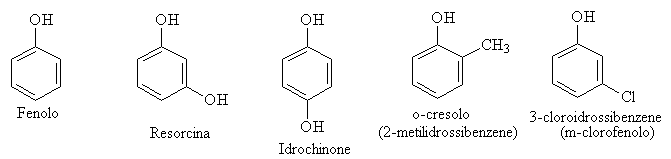
Gli eteri sono dei composti in cui due gruppi alchilici sono legati ad uno stesso atomo di ossigeno. Se i due gruppi sono uguali parliamo di eteri simmetrici se sono differenti sono eteri misti o asimmetrici.
![]()
Sono composti derivanti dall'ammoniaca. Si dividono in primarie, secondarie, terziarie a seconda di quanti sono i gruppi alchilici legati all'azoto che sostituiscono gli idrogeni.
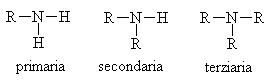
Nelle regole di nomenclatura, individuata e numerata la catena carboniosa più lunga secondo il solito criterio, si aggiunge alla desinenza -o dell'alcano la parola ammina.
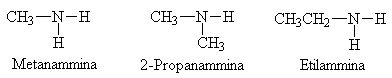
Nel caso di ammine secondarie si scrive N-gruppo alchilico sostituente più il nome della catena idrocarburica più lunga con alla fine ammina.
Nel caso di ammine terziarie si scrive N,N'-gruppi alchilici sostituenti più il nome della catena idrocarburica più lunga con alla fine ammina.
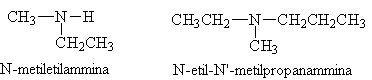
Molto importanti dal punto di vista biologico sono le ammine aromatiche in cui uno solo degli idrogeni dell'ammoniaca è sostituito dal benzene. Nella nomenclatura comune si fa riferimento all'anilina.
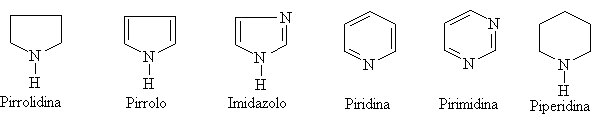
Nel mondo naturale gli eterocicli contenenti uno o più atomi di azoto sono diffusissimi con anelli prevalentemente a cinque o a sei termini.
La presenza dell'azoto determina le proprietà della molecola dovute alla presenza del doppietto elettronico non condiviso. I più comuni sono:
Spesso i composti eterociclici a 5 o 6 termini si presentano condensati. Di preminente interesse sono l'indolo e la purina.
Il tipico gruppo funzionale di questi composti è il carbonile in cui l'atomo di carbonio legato all'ossigeno è ibridizzato sp2.
ALDEIDI: gruppo carbonilico legato ad un idrogeno e ad un gruppo alchilico.
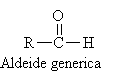
Per denominare le aldeidi basta sostituire alla desinenza -o, dell'alcano corrispondente alla catena più lunga contenente il gruppo aldeidico, la desinenza -ale. (in parentesi i nomi comuni). Poiché il gruppo aldeidico è un gruppo terminale la sua posizione nella catena principale non è specificata. Se ci sono dei sostituenti è implicito che il carbonio carbonilico occupi la posizione 1.
|
Formula di Struttura |
Nome |
|
HCHO |
Metanale (aldeide formica) |
|
CH3CHO |
Etanale (acetaldeide) |
|
CH3-CH2CH2CHO |
Butanale (aldeide butirrica) |
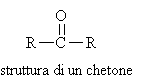
I CHETONI assumono denominazione secondo le regole IUPAC, sostituendo il suffisso -o dell'alcano con -one ed indicando con un numero la posizione del gruppo C=O. La numerazione inizia dall'estremità più vicina al carbonile. (in parentesi i nomi comuni).
|
Formula di Struttura |
Nome |
|
CH3COCH3 |
Propanone (acetone) |
|
CH3CH2COCH3 |
2-Butanone |
|
CH3-CH2CH2COCH3 |
2-Pentanone |
I nomi correnti dei chetoni si ottengono specificando il nome dei due gruppi legati al carbonio carbonilico ed aggiungendo il termine chetone
ADDIZIONE NUCLEOFILA AL GRUPPO CARBONILE
Le reazioni caratteristiche delle aldeidi e dei chetoni sono le reazioni di addizione nucleofila al doppio legame carbonio-ossigeno. Per nucleofilo si intende una molecola o ione in grado di cedere coppie di elettroni .
Gli elettroni del doppio legame carbonilico non sono uniformemente distribuiti. Il carbonio carbonilico porta una parziale carica positiva mentre l'ossigeno una parziale carica negativa. Il carbonile quindi è un gruppo polarizzato. Tale distribuzione di carica è dovuta ad un effetto induttivo causato dalla forte elettronegatività dell'atomo di ossigeno, e dal fatto che i due elettroni del legame p (del doppio legame C=O) sono spostati completamente sull'atomo di ossigeno (effetto di risonanza).

Possiamo visualizzare l'addizione nucleofila al gruppo carbonile in due schemi generali. Se abbiamo un nucleofilo forte il meccanismo della reazione è la seguente:
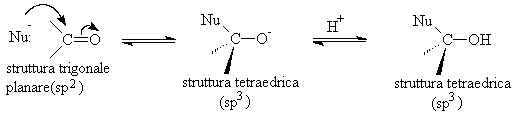
Nel primo passaggio il nucleofilo si somma al carbonio del carbonile e la coppia di elettroni p del doppio legame si trasferisce sull'ossigeno. Nell'intermedio tetraedrico l'ossigeno che ha acquistato carattere di una base forte portando una carica negativa riceve un protone H+ dal solvente (acqua o un alcol) e si trasforma nel prodotto finale.
Se invece il nucleofilo è debole possiamo rappresentare la reazione nel seguente modo:
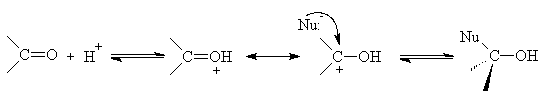
Nel primo stadio l'acido attacca l'ossigeno protonando il composto carbonilico che così diventa molto reattivo verso il nucleofilo debole.
ADDIZIONE DI ALCOLI AL GRUPPO CARBONILICO: ACETALI e CHETALI
In seguito all'addizione di un alcool su un gruppo carbonilico si ottiene un EMIACETALE
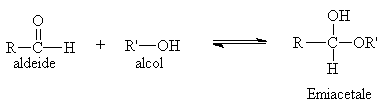
La stabilità della maggior parte degli emiacetali a catena aperta non è sufficientemente alta da permettere il loro isolamento infatti tendono a reagire con un'altra molecola di alcol per formare gli ACETALI. Invece, gli emiacetali ciclici con anelli a cinque e sei termini sono nettamente stabili come vedremo in seguito negli zuccheri semplici.

Composti caratterizzati dalla presenza di un gruppo carbossile -COOH.
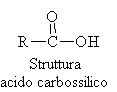
Nella regola IUPAC il nome è preceduto dalla dicitura acido seguito dal nome derivante dall'idrocarburo con catena di pari lunghezza sostituendo il finale -o con il suffisso -oico.
|
Formula di Struttura |
Nome |
|
HCOOH |
Acido Metanoico (acido formico) |
|
CH3COOH |
" Etanoico (acido acetico) |
|
CH3-CH2COOH |
" Propanoico (acido propionico) |
|
CH3-CH2-CH2-COOH |
" Butanoico (acido butirrico) |
Per i nomi comuni il suffisso è -ico. Se il gruppo funzionale degli acidi è attaccato a un ciclo, il composto può essere denominato usando il suffisso -carbossilico.

Nomi comuni sono particolarmente diffusi tra i composti acidi aromatici:
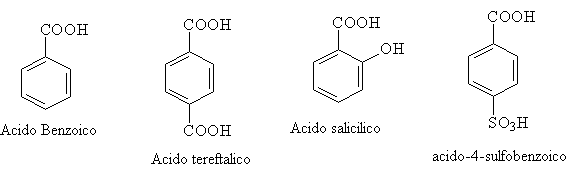
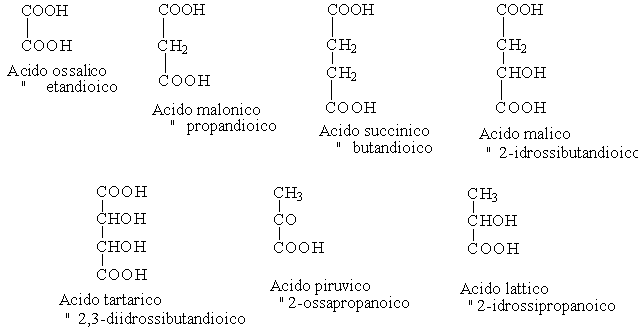
La numerazione parte dall'atomo di carbonio a cui è legato il carbossile e segue le note regole assegnando i numeri più bassi possibili ai gruppi funzionali. La nomenclatura IUPAC prevede la sostituzione dell'- o finali dell'idrocarburo da cui derivano col suffisso - dioico. ( Il primo nome è quello comune) Alcuni acidi bicarbossilici, idrossiacidi e chetoacidi hanno notevole importanza in campo biochimico.
I nomi degli esteri sono formati da due termini che individuano rispettivamente l'acido carbossilico (sostituendo la desinenza -ico o -oico con -ato o -oato) e l'alcol, usando il nome del corrispondente gruppo alchilico.
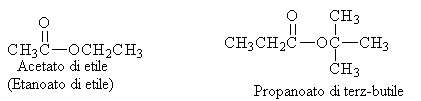
Le ammidi sono dei composti derivati dagli acidi carbossilici caratterizzati dalla presenza nella molecola del gruppo funzionale - CONH2. La denominazione delle ammidi deriva da quella degli acidi, sostituendo i suffissi -oico ed -ico con ammide.

Dato un composto organico si deve identificare la catena più lunga. Il numero di atomi di carbonio di questa determina il nome fondamentale della molecola.
Si numera la catena normale di atomi di carbonio in modo che i sostituenti abbiano il numero più basso.
Se sono presenti due o più sostituenti si individua la loro posizione con il numero del carbonio a cui sono rispettivamente legati.
Gruppi di uguale importanza si scrivono in ordine alfabetico.
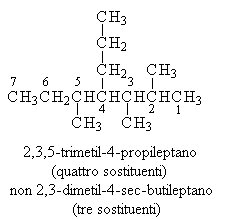
Quando vi sono due sostituenti identici si indicano insieme le posizioni e al nome del sostituente si aggiunge il prefisso che ne indica la quantità
Se i sostituenti identici si trovano sullo stesso carbonio, questo va numerato due volte con lo stesso numero dove il secondo avrà l'apice.
La catena principale va numerata in modo che i gruppi con priorità maggiore possiedano il numero più basso
L'esistenza degli enantiomeri è legata ad una proprietà strutturale delle molecole: la chiralità. Una molecola è definita chirale quando non è sovrapponibile alla sua immagine speculare. Chirale infatti deriva dal greco e significa mano. Il suo uso deriva dal fatto che la relazione tra due enantiomeri è la stessa che intercorre tra la mano destra e quella sinistra. Quando noi vediamo la mano sinistra riflessa nello specchio noi guardiamo la mano destra, cioè la sua immagine speculare non sovrapponibile. Tutte le molecole che contengono un atomo di carbonio chirale esistono sotto forma di enantiomeri. Un carbonio è chirale quando lega 4 gruppi o 4 atomi diversi. Il numero di stereoisomeri che si possono ottenere per una molecola sono 2n dove n è il numero di centri asimmetrici presenti.
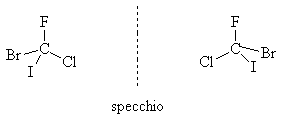
Quando l'atomo di carbonio ibridizzato sp3 è asimmetrico ci sono due, e solo due, configurazioni tetraedriche che sono l'immagine speculare l'una dell'altra e non sono sovrapponibili. Ad esempio, la molecola CFClBrI può esistere in due forme non sovrapponibili
A livello macroscopico la chiralità delle molecole è svelata da un fenomeno fisico, la capacità di far ruotare il piano della luce polarizzata. Tali molecole quindi manifestano attività ottica. Che cosa è la luce polarizzata? La luce visibile è un' onda elettromagnetica che si propaga. Un raggio di luce consiste in due campi che vibrano in piani perpendicolari fra loro: un campo elettrico oscillante ed uno magnetico oscillante. I piani in cui avvengono le vibrazioni oltre ad essere perpendicolari fra di loro sono perpendicolari alla direzione di propagazione del raggio. Le vibrazioni del campo elettrico avvengono in tutti i possibili piani perpendicolari alla direzione di propagazione della luce. Quando la luce ordinaria attraversa un polarizzatore vi è una interazione tra polarizzatore e campo elettrico con conseguenza che la luce che emerge vibra in un solo piano. Questa luce si chiama luce polarizzata. L'occhio umano non distingue la luce polarizzata da quella naturale. Pertanto bisogna far ricorso a uno strumento il polarimetro. Quello che dobbiamo misurare è l'angolo di rotazione causato dall'introduzione del campione otticamente attivo. Se l'analizzatore del polarimetro è ruotato in senso orario per ripristinare l'intensità della luce ottenuta con l'azzeramento dello strumento, l'angolo a di rotazione è registrato positivo (+) e la sostanza è chiamata destrogira. Se invece la rotazione è antioraria l'angolo a è negativo (-) e la sostanza è considerata levogira.
Nel 1891 Fischer inventò un modo per rappresentare sul piano l'atomo di carbonio asimmetrico (con 4 sostituenti differenti). Secondo la sua simbologia i due legami che vengono sopra il piano del foglio sono disegnati in orizzontale, mentre quelli diretti sotto il foglio sono verticali. Il carbonio si trova nel punto di incrocio.
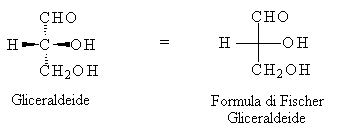
I legami tratteggiati sono quelli che attraversano il foglio, quelli riempiti in nero sono quelli che vengono sopra il piano del foglio.
L'orientazione dei sostituenti di un atomo di carbonio asimmetrico è chiamata configurazione. Il sistema più diffuso è quello R-S. Per stabilire le configurazione assoluta di un atomo di C si devono seguire le regole di priorità. I simboli R o S sono assegnati nel modo seguente:
Br > Cl > O > N > C > H
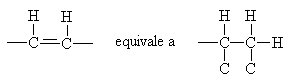
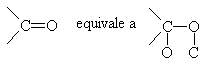
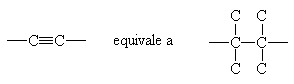
Facciamo un esempio applicando le regole della priorità.
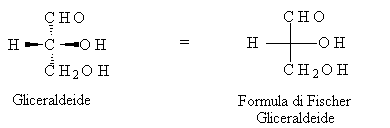
La priorità più alta appartiene per la gliceraldeide all'-OH e la più bassa all' -H. Il gruppo -CHO prevale sul gruppo -CH2OH. Quindi l'ordine finale di priorità è il seguente:
OH > CHO > CH2OH > H
Andando dal sostituente a più alta priorità a quello a più bassa se la rotazione è concorde con quella delle lancette dell'orologio, cioè in senso orario, l'atomo di carbonio asimmetrico avrà configurazione R se la rotazione è opposta a quella delle lancette dell'orologio, senso antiorario, sarà configurazione S.
Nel caso della molecola da noi presa come esempio, mantenendo fisso il gruppo CH2OH facciamo ruotare in senso orario gli altri tre sostituenti di 90° come indicato dalle frecce.
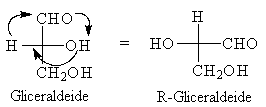
Il movimento è necessario per posizionare in alto H che ha la priorità più bassa. Per assegnare la corretta configurazione assoluta è conveniente porre sempre in alto il gruppo a più bassa priorità. oppure basta invertire la configurazione che otteniamo lasciando la molecola scritta come all'inizio.
La gliceraldeide sopra raffigurata ha configurazione assoluta R.
CARBOIDRATI (ZUCCHERI)
I carboidrati (idrati del carbonio) sono un gruppo di composti che hanno formula generale Cn(H2O)m. La definizione corrente è: composti organici contenenti funzioni carboniliche (aldeidiche e chetoniche) e funzioni alcoliche. Possiamo quindi definire tali composti dei poliidrossialdeidi o poliidrossichetoni otticamente attivi in quanto contengono almeno un atomo di carbonio chirale. I monosaccaridi (carboidrati che non possono formare per idrolisi zuccheri più semplici) si possono classificare in base al numero di atomi di carbonio presenti nella molecola (triosi, tetrosi, pentosi, esosi). La struttura più semplice per i monosaccaridi è quella aperta ossia quella costituita da una catena lineare con funzioni aldeidiche o chetoniche libere. Gli atomi di carbonio vengono numerati secondo le regole IUPAC attribuendo al carbonio carbonilico il numero più basso possibile.
I monosaccaridi più semplici sono la gliceraldeide e il diidrossiacetone.
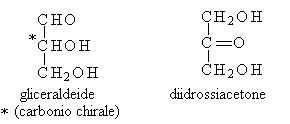
Secondo le convenzioni la (+)-gliceraldeide ha configurazione assoluta R, la (-) gliceraldeide ha configurazione S. E' stato visto come prima che si determinassero le configurazioni assolute, si erano stabilite le configurazioni relative di composti otticamente attivi scegliendo come composti di riferimento i due enantiomeri della gliceraldeide. Alla (+)-gliceraldeide fu assegnata arbitrariamente la configurazione D mentre alla (-)-gliceraldeide la configurazione L. Pertanto un qualsiasi monosaccaride è di serie D oppure L quando il suo ultimo carbonio chirale ha la stessa configurazione della D o L gliceraldeide oppure possiamo anche dire a seconda della struttura dell'atomo di carbonio chirale più lontano dal gruppo carbonilico.
I carboidrati di maggior interesse dal punto di vista biologico e quindi analizzati nei vari corsi di studio, sono quelli della serie D-aldosi (derivanti dalla D-gliceraldeide). Possiamo rappresentare la serie con i rispettivi nomi mediante le formule di Fischer (Tabella 1).
Struttura ciclica dei monosaccaridi
La struttura aperta dei monosaccaridi non consente di chiarire del tutto il comportamento chimico-fisico di tali composti. Gli zuccheri dato che posseggono un gruppo carbonilico e diversi gruppi ossidrili nella stessa molecola hanno la tendenza a dare addizione nucleofila interna intramolecolare (tra il carbonile e l'ossidrile in posizione 5) e a trasformarsi in EMIACETALI CICLICI, con anelli relativamente stabili a cinque e sei termini. La formazione della nuova molecola ciclica fa nascere un nuovo centro chirale il C1. Si avranno due diastereoisomeri che chiameremo ANOMERI. Il carbonio C1 si definisce ANOMERICO e il nuovo ossidrile ossidrile anomerico. I due composti saranno rispettivamente l'anomero a e b secondo l'orientamento dell'ossidrile emiacetalico. Si instaura un vero e proprio equilibrio-chimico tra la forma aperta e i due anomeri a e b. Possiamo ricorrere a diversi tipi di formule per rappresentare le strutture cicliche dei carboidrati. Abbiamo le ben note formule proiettive di Fischer ,oppure le rappresentazioni planari di Haworth, o le rappresentazioni più aderenti alla realtà quelle conformazionali cioè quelle a sedia del cicloesano.
Strutture di Fischer:
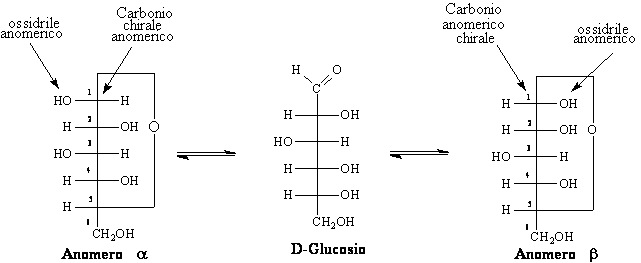
Secondo le proiezioni di Fischer per convenzione per i D-zuccheri, l'anomero a è quello il cui -OH anomerico cade a destra rispetto la catena, mentre l'anomero b quello con l'-OH a sinistra.
Disegnando gli zuccheri con le strutture di Haworth abbiamo:

L'anomero a è quello il cui -OH anomerico cade in basso, mentre l'anomero b quello con l'-OH diretto in alto.
Per rappresentare tali strutture, come si può anche osservare nello schema, abbiamo fatto ruotare prima il gruppo CH-CH2OH intorno al C-4, e in seguito il gruppo OH si addiziona al C=O per formare la struttura ciclica. Nella denominazione dei monosaccaridi la dimensione del ciclo è suggerita dai suffissi -piranosio e -furanosio. Questi termini sono adottati per la somiglianza strutturale dei monosaccaridi con gli eterocicli (cicli in cui sono presenti anche elementi differenti dal carbonio) pirano (a sei termini) e furano (a cinque termini).
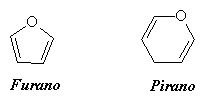
Rappresentazioni conformazionali degli zuccheri:
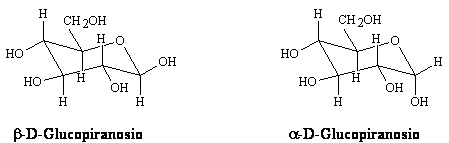
Per il fruttosio abbiamo una struttura a cinque termini simile all'eterociclo furano.
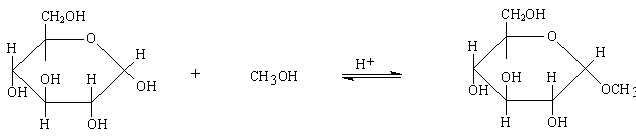
Formazione di O-glicosidi
Gli zuccheri reagiscono mediante l'-OH anomerico con composti che possiedono funzioni alcoliche o fenoliche per formare O-glicosidi composti che formalmente sono eteri.
Esterificazione
Per via chimica tutti gli ossidrili possono essere esterificati con acidi organici, inorganici o loro derivati. Nella cellula le esterificazioni possono venire ad opera di enzimi. Molto importanti sono le esterificazioni con acido fosforico dette fosforilazioni che trasformano gli zuccheri in composti biologicamente attivi.

Formazione di N-glicosidi
Gli zuccheri reagiscono con composti azotati come ammine, amminoacidi, purine pirimidine per dare N-glucosidi.
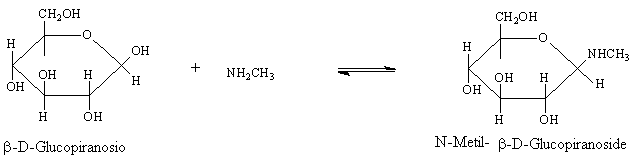

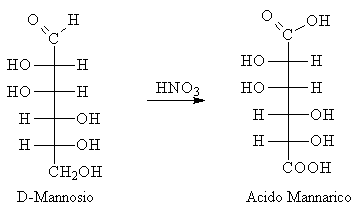
Reazioni di ossidazione
L'acido nitrico è un forte ossidazione e ossida tutti gli zuccheri ad acidi bicarbossilici chiamati genericamente acidi glicarici.
Per quel che riguarda un chetoso abbiamo l'ossidazione del fruttosio

Con ossidanti blandi il processo di ossidazione avviene solo per gli aldosi e si arresta agli acidi gliconici cioè ai corrispondenti acidi monocarbossilici; questo succede con l'acqua di bromo.
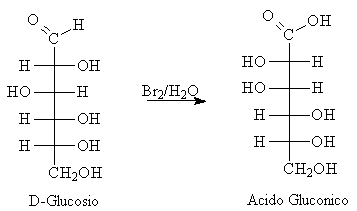
Reazioni di riduzione
Il gruppo carbonilico può essere ridotto al gruppo alcolico corrispondente. I prodotti che si ottengono sono polialcoli che prendono il nome generico di alditoli. I riducenti utilizzati sono idrogeno in presenza di nichel di Raney o in presenza di sodio amalgamato o il boroidruro di sodio che essendo solubile in acqua come gli zuccheri consente di operare in ambiente acquoso.

ALBERO GENEALOGICO dei D-ALDOSI. Proiezioni di Fischer
Tabella 1

DISACCARIDI
I disaccaridi sono particolari emiacetali formati fra l'-OH anomerico di un monosaccaride e l'-OH alcolico di un altro monosaccaride. Tutti gli -OH alcolici dei monosaccaridi si possono comportare da nucleofili ( specii in grado di cedere un doppietto) per dare emiacetali ma in natura è più comune l'attacco da parte degli -OH nelle posizioni in C4 e in C6.
Per definire più dettagliatamente la struttura di un disaccaride bisogna conoscere:
la natura dei monosaccaridi
quale monosaccaride fornisce l'-OH anomerico e quale l'-OH alcolico
fra quali carboni si forma il legame a ponte che unisce i due monosaccaridi
la configurazione a o b di tale legame
la conformazione piranosica o furanosica dei due zuccheri.
I disaccaridi più importanti sono il maltosio e il cellobiosio che rappresentano in natura rispettivamente le unità costruttive dell'amido e della cellulosa; il lattosio è lo zucchero del latte dei mammiferi. Infine il saccarosio che costituisce il comune zucchero commerciale. La struttura di questi disaccaridi è stata determinata ricorrendo a una serie di reazioni più o meno complesse. Ad esempio con l'idrolisi chimica è stato possibile stabilire la natura dei due monosaccaridi e con quella enzimatica la configurazione a o b del loro legame.
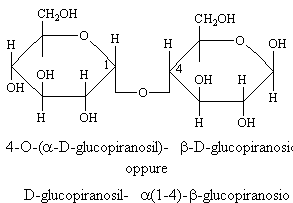
MALTOSIO
Dall'idrolisi chimica si è visto che è costituito da due molecole di glucosio. Il legame fra le due molecole di glucosio è di tipo a
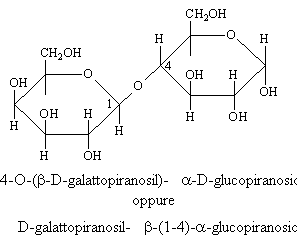
LATTOSIO
E' un disaccaride formato da due monosaccaridi diversi: il galattosio che impegna l'-OH anomerico con l'-OH in C4 del glucosio in un legame di tipo b
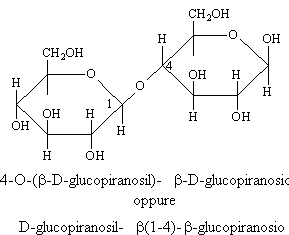
CELLOBIOSIO
E' formato come il maltosio da due molecole di glucosio in forma piranosica ma questa volta il legame fra il C1 e il C4 è del tipo b
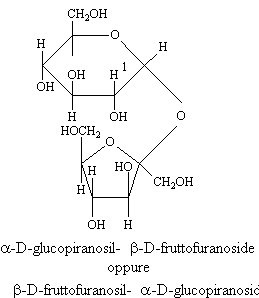
SACCAROSIO
Questo è un disaccaride formato da glucosio e fruttosio. La sua importante particolarità strutturale le conferisce delle proprietà diverse.
Infatti il glucosio in forma a-piranosica e il fruttosio in forma b-furanosica danno un legame con i loro -OH anomerici.
POLISACCARIDI
I polisaccaridi sono polimeri di monosaccaridi o di loro derivati, legati fra loro con legami glicosidici.
AMIDO
Nelle molecole di amido sono generalmente presenti due frazioni: l'amilosio e l'amilopectina. L'amilosio è solubile in acqua ed è costituito da catene lineari unite fra loro solo con legame a (1-4) la cui unità costitutiva di base è il maltosio. L'amilopectina è invece insolubile in acqua ed è costituita anche in questo caso da unità di glucosio unite fra loro non solo con legami a (1-4) ma anche a (1-6) che danno luogo a ramificazioni. Si deve quindi parlare di amidi poiché ogni tipo di amido sarà formato da amilosio e amilopectina presenti in percentuali variabili come inoltre saranno variabili il grado di polimerizzazione e di ramificazione dell'amilopectina.
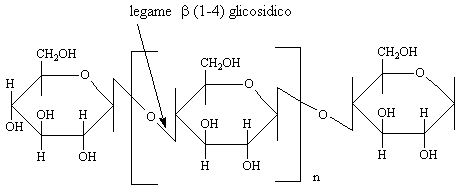
CELLULOSA
La cellulosa è il composto organico più diffuso in natura strutturalmente è un polimero lineare del D-glucopiranosio con legami tutti b (1-4). Purtroppo nel nostro organismo la mancanza di enzimi specifici per il legame b (1-4) glucosidico ci impedisce di utilizzare direttamente tale elemento.
ACIDI GRASSI
Gli acidi grassi presentano generalmente queste caratteristiche:
Gli acidi grassi insaturi naturali possiedono la struttura dell'isomero Z o cis.

Tali composti hanno una densità inferiore a 1 e sono insolubili in acqua a causa del prevalere della parte idrocarburica, idrofobica, sulla parte idrofila del carbossile. Il punto di fusione degli acidi grassi è influenzato sia dalla lunghezza della catena, sia dalla presenza dei doppi legami. A temperatura ambiente gli acidi grassi saturi sono allo stato solido, mentre quelli insaturi sono liquidi.
Gliceridi
L'esterificazione parziale o totale del glicerolo, alcol con tre gruppi funzionali, con acidi grassi porta alla formazione di diversi gliceridi.
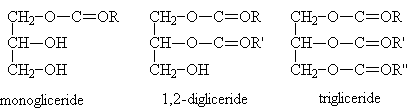
I trigliceridi nonostante la presenza del gruppo estereo polare, si considerano apolare per la preponderanza delle catene alifatiche.
PROTEINE
Quando viene idrolizzata una proteina con acidi o basi diluite o enzimi idrolitici, il risultato è una miscela di a-amminoacidi. Un a-amminoacido contiene il gruppo ammino -NH2 sull'atomo di carbonio in posizione a cioè adiacente al gruppo carbossilico.
A parte la glicina, gli amminoacidi presenti in natura sono otticamente attivi, per lo più con configurazione L. La struttura di riferimento per stabilire la configurazione assoluta degli ammino acidi è ancora la gliceraldeide, con il gruppo ammino che sostituisce il gruppo -OH e il gruppo carbossilico al posto del -CHO. La molecola mostrata ha una configurazione L poiché il gruppo NH2 compare a sinistra.
Tali composti sono solidi cristallini bianchi con caratteristiche chimico fisiche paragonabili a quelle dei composti ionici; infatti presentano punti di fusione elevati e scarsa solubilità nei solventi apolari. Questo comportamento è dovuto alla possibilità che questi composti esistano nella forma ionica dipolare o "zwitterione".Quando la soluzione acquosa è acida o basica, per il carattere anfotero degli amminoacidi prevarranno rispettivamente la forma cationica o anionica. Quindi come possiamo vedere l'amminoacido risente del pH dell'ambiente.
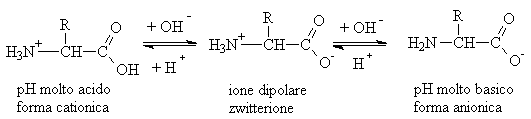
In soluzioni fortemente acide l'amminoacido esiste come catione, con un protone proveniente dalla soluzione che si coordina all'atomo di azoto formando NH3+. In soluzione fortemente basica si forma un anione, mediante la perdita di protoni da parte di -CO2H o NH3. Ad un punto intermedio si ha perdita di un protone da parte di -CO2H mentre viene mantenuto da -NH3. Il pH in cui l'amminoacido esiste in forma dipolare si chiama punto isoelettrico e può non coincidere col pH=7 perchè le due funzioni amminica e carbossilica hanno costanti di dissociazione diverse.
PEPTIDI
Una delle più importanti caratteristiche reazioni degli amminoacidi è quella fra il gruppo carbossilico e il gruppo amminico di due amminoacidi, uguali o diversi, che si uniscono per formare un legame ammidico.
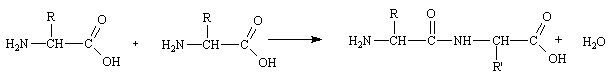
Questo dimero prende il nome di dipeptide, Se sono presenti più amminoacidi legati tra di loro ho la formazione di una catena polipeptidica.
Le proteine sono dei polimeri costituite da catene polipeptidiche lineari con più di 100 amminoacidi ed hanno un peso molecolare fra 10000 e 1000000 dalton.
La sequenza di amminoacidi contiene in sé tutte le informazioni che attraverso tre diversi gradi di organizzazione portano alla struttura finale.
ACIDI NUCLEICI
Gli zuccheri presenti nella struttura degli acidi nucleici DNA e RNA, sono due aldopentosi: il D-ribosio e presente nell'RNA (acido ribonucleico) e il 2-desossi-D-ribosio nel DNA (acido desossiribonucleico)
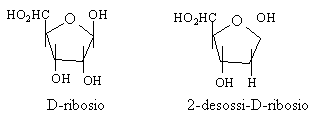
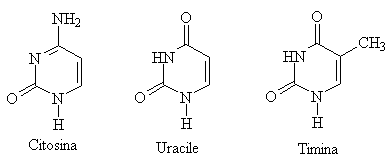
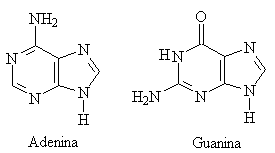
Le basi azotate sono derivate da due basi eterocicliche fondamentali, la pirimidina e la purina (vedi ammine). Le principale basi pirimidiniche sono la citosina presente nel DNA e nell'RNA, e la timida nel DNA e l'uracile nell'RNA. Le principali basei puriniche sono l'adenina e la guanina presenti sia nell'RNA che nel DNA.
Le basi puriniche e pirimidiniche si uniscono ai rispettivi zuccheri con un legame b-glicosidico per dare i nucleosidi, e quest'ultimi con acido fosforico danno degli esteri monofosforici detti nucleotidi. Normalmente l'esterificazione viene a carico dell'ossidrile del pentoso in posizione C-5. (vedi esterificazione degli zuccheri)
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2024