|
|
| |
PRODUZIONE DI IMMAGINI
Alcuni concetti e definizioni
In termini generali, la produzione di immagini può essere definita come una tecnica di rappresentazione di variazioni spaziali e/o temporali di una proprietà fisica, o di una combinazione di proprietà, di un oggetto in esame. La tecnica si dice statica se non si considerano variazioni nel tempo oppure dinamica se assumono rilevanza le variazioni temporali delle grandezze in esame. Nelle immagini prodotte le caratteristiche sono rappresentate in scala di grigi o in falsi colori e possono descrivere la struttura interna dell'oggetto o alcuni aspetti della sua attività; nelle applicazioni mediche tali immagini rivelano strutture anatomiche o funzioni fisiologiche o, talvolta, entrambe [Kouris et al. 1982].
Il processo di formazione dell'immagine implica l'interazione con l'oggetto di un certo tipo di radiazione che, a sua volta, interagisce con un sistema di rivelazione. La radiazione opera come una sonda all'interno dell'oggetto che introduce una perturbazione spaziale e temporale sul campo di radiazione generando segnali che, opportunamente interpretati, sono utilizzati per la ricostruzione di un'immagine.
La definizione piuttosto generale riguarda la produzione di immagini con ultrasuoni, con onde radio e microonde, con radiazioni termiche, ottiche ed ultraviolette come pure con raggi X e g, neutroni, e particelle cariche. Tali tecniche trova 333j93d no applicazione, oltre che in Medicina, in numerose altre discipline.
I diversi tipi di radiazione possono essere distinti dagli effetti sul mezzo attraversato. E' essenziale che abbiano luogo delle interazioni, altrimenti non potrebbe essere ottenuta alcuna informazione; sfortunatamente, le interazioni possono danneggiare il mezzo interessato. Nel caso di un tessuto biologico, l'energia viene trasferita con eccitazioni e ionizzazioni alle molecole, e particolarmente alle abbondanti molecole dell'acqua. I processi fisici sono seguiti da reazioni chimiche che creano radicali liberi che, a loro volta, possono reagire con altre molecole di importanza biologica cambiando la struttura di enzimi, proteine ed acidi nucleici; tali modificazioni possono infine condurre anche alla morte della cellula. Nella produzione di immagini in Medicina è perciò necessario ricavare il massimo di informazione possibile con il minimo danno ai tessuti, in particolare quando siano necessari ripetuti esami diagnostici. Quindi è essenziale avere una conoscenza quantitativa della dose di radiazione somministrata in ciascun esame e deve essere valutato l'effetto delle nuove tecniche sui materiali biologici.
Si distingue inoltre tra produzione di immagini in emissione ed in trasmissione.
Nel primo caso, viene misurata la distribuzione di attività di un radionuclide in una porzione di un organismo vivente o dove un meccanismo di flusso causa il trasferimento del radionuclide attraverso una regione. A tale scopo viene somministrato al paziente un radiofarmaco caratterizzato da una captazione preferenziale in una regione di interesse ed in tessuti normali ed anormali. L'entità e la distribuzione relativa dell'attività del radionuclide dipendono dal suo tempo di decadimento e dai processi biologici di assorbimento e rimozione del farmaco. Se il radionuclide è un emettitore g di energia sufficiente allora essi possono essere rivelati all'esterno del corpo e, poiché i raggi g non possono essere focalizzati, la formazione dell'immagine richiede una stima delle loro traiettorie per poter correlare i punti di rivelazione con i punti o le zone di emissione. Quindi il rivelatore deve essere sensibile alla posizione spaziale; di solito questa sensibilità è ottenuta con l'uso di collimatori multi-fori o ad ingrandimento (pinhole) accoppiati con rivelatori sensibili alla posizione o con rivelatori mobili. Alcuni radionuclidi a vita breve che possono essere associati a molecole di interesse biologico sono emettitori di b ; questi perdono rapidamente la loro energia prima di subire i processi di annichilazione in prossimità di elettroni atomici del mezzo attraversato producendo una coppia di raggi g; anche questo processo viene sfruttato per la produzione di immagini in emissione.
La produzione di immagini in trasmissione è eseguita con fasci di raggi X, g, neutroni o particelle cariche; il fascio interagisce con l'oggetto in esame ed è osservato da un dispositivo situato sul lato opposto. E' possibile apprezzare diversi comportamenti del mezzo assorbente perché il coefficiente di attenuazione, che governa la perdita di energia, dipende dai parametri fisici del materiale stesso.
Nella radiografia in trasmissione l'immagine rappresenta la proiezione su di un piano (di solito coincidente con una pellicola fotografica) dell'assorbimento esercitato dall'oggetto; in tomografia viene acquisita una serie di immagini di sottili fette dell'oggetto utilizzando molteplici punti di osservazione per formare un insieme di profili di assorbimento dai quali si ricostruisce un'immagine tridimensionale. La tomografia può essere effettuata anche con ultrasuoni, in risonanza magnetica nucleare e con altre tecniche meno diffuse.
Produzione di immagini con radionuclidi [Webb 1993]
L'uso di radionuclidi in tracce per la diagnosi clinica di malattie umane è cresciuto rapidamente nel corso degli anni 1970 ed è divenuta una disciplina medica conosciuta sotto il nome di Medicina Nucleare [Wagner 1975, Maisey 1980, Sharp et al. 1985]. La generazione di immagini con radioisotopi si avvale delle proprietà di diffusione nel corpo di particolari sostanze radiomarcate. Tali sostanze, conosciute come radiofarmaci, sono state ideate per evidenziare le funzionalità fisiologiche di singoli organi del corpo; la loro diffusione all'interno del corpo è determinata dal modo di somministrazione e da altri fattori come il flusso ed il volume di sangue e da una molteplicità di processi metabolici. Le tecniche qui discusse si distinguono fortemente da quelle che forniscono essenzialmente dettagli anatomici di organi del copro.
L'uso del primo radioisotopo (131I) per studiare le malattie della tiroide risale agli ultimi anni 1930; i primi dispositivi (scanner rettilineo, camera a scintillazione) vengono sviluppati negli anni 1950 giungendo ad una certa diffusione intorno alla metà degli anni 1960. A partire da quegli anni la Anger-camera diviene lo strumento principale nella produzione di immagini con radionuclidi.
Con tali tecniche si possono ricavare una certa quantità di informazioni cliniche; per esempio la scintigrafia planare è ancora oggi il mezzo diagnostico più diffuso in Medicina Nucleare. Una di tali immagini consiste nella rappresentazione bidimensionale, nel piano di osservazione del rivelatore, della proiezione di una distribuzione tridimensionale di attività presente all'interno della regione in esame. In radiografia X sono note per ciascun fotone entrambe le posizioni (emissione e rivelazione) mentre, nella produzione d'immagini con radiofarmaci è nota solamente la posizione di rivelazione. Per ottenere un'immagine è necessario perciò introdurre un dispositivo (meccanico o elettronico) di collimazione che selezioni la direzione dei raggi g rivelati.
Gli andamenti temporali della distribuzione spaziale di radiofarmaci possono essere ottenuti con acquisizioni in tempi successivi con durata delle osservazioni che può variare da qualche millesimo di secondo a centinaia di secondi. Questa modalità, conosciuta come scintigrafia dinamica, è di interesse fondamentale per lo studio delle caratteristiche funzionali di base dell'organo sottoposto ad esame.
Poiché un'immagine planare contiene informazioni derivate da un oggetto tridimensionale, è spesso difficile determinare in modo chiaro la funzionalità di un tessuto localizzato in profondità. Gli studi tomografici, ottenuti eseguendo acquisizioni da diversi punti di osservazione dell'oggetto, risolvono molti problemi causati dalla sovrapposizione di informazione in una singola vista planare.
Il decadimento radioattivo produce, a seconda del radionuclide, l'emissione di particelle a, b, g e di raggi X. Il percorso delle prime due nei tessuti è troppo piccolo per consentire studi in vivo utilizzando rivelatori esterni al corpo, ma i raggi X e g penetrano nei tessuti in modo soddisfacente.
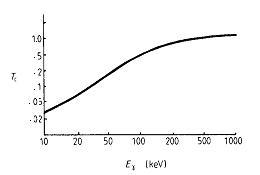
fig.1.1 Andamento del coefficiente di trasmissione relativo nei tessuti in funzione dell'energia dei fotoni
La fig.1.1 mostra il forte assorbimento (fotoelettrico) esercitato da parte dei tessuti del corpo sui fotoni X e g di energia inferiore a 100 keV; ad energie superiori i processi prevalenti sono costituiti da diffusioni Compton, mentre l'assorbimento con creazione di coppie diviene preponderante per energie superiori ad 1 MeV. Per questo motivo la generazione di immagini con radionuclidi richiede l'uso di emettitori di fotoni con energie maggiori di 50 keV.
I materiali scintillanti che emettono luce visibile (o quasi visibile) a seguito di interazioni con radiazioni ionizzanti sono largamente impiegati sia come contatori che come rivelatori per la produzione di immagini [Birks 1964]. Se le caratteristiche della luce emessa si accordano bene con quelle di sensibilità spettrale dei fototubi e se il materiale scintillante è trasparente alla propria luce, allora i rivelatori di radiazioni ionizzanti basati sul loro accoppiamento saranno dotati di sensibilità elevata. Si riportano a tale proposito nell'appendice A cenni alla teoria dei rivelatori a scintillazione.
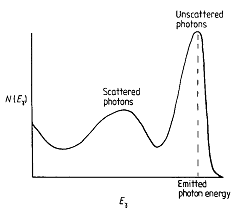
fig.1.2 Spettro delle ampiezze degli impulsi ottenuto da uno scintillatore inorganico con fotoni g monocromatici
L'emissione luminosa di molti materiali scintillanti inorganici è proporzionale all'energia depositata nel materiale; ciò rende quindi possibile non solo la rivelazione dei fotoni, ma anche la misura della loro energia. Tipicamente i valori della risoluzione energetica di un rivelatore a scintillazione si collocano intorno al 10-15% per energie di 100-200 keV (fig.1.2) e ciò consente di effettuare elettronicamente e con discreto successo la discriminazione tra i fotoni incollisi e quelli che hanno perso energia in interazioni Compton all'interno del corpo.
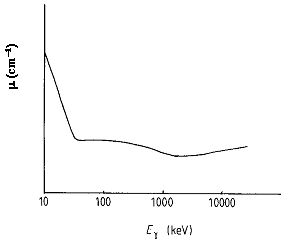
fig.1.3 Andamento del coefficiente di assorbimento di un cristallo NaI(Tl) in funzione dell'energia dei fotoni
La fig.1.3 mostra l'andamento qualitativo del coefficiente di assorbimento dei fotoni in un cristallo NaI(Tl) in funzione dell'energia.
Tenendo conto dell'andamento qualitativo di fig.1.1, si individua una regione di energie dei raggi g tra 50 e 500 keV nella quale la quantità Tc m è più elevata ed i rivelatori a scintillazione possono essere impiegati più efficacemente per la produzione di immagini con radionuclidi (fig.1.4).
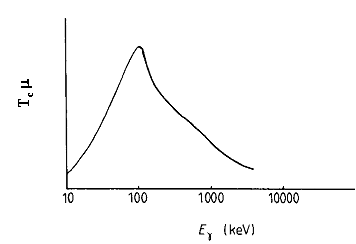
fig.1.4 Andamento di Tc m in funzione dell'energia dei fotoni
Radionuclidi impiegati per la produzione di immagini
Uno dei principali vantaggi derivanti dall'uso di radionuclidi in Medicina è costituito dal rilevante segnale (la radiazione emessa) che si ottiene, per un certo studio, usando quantità relativamente piccole di traccianti. La Medicina Nucleare trae vantaggio da tale caratteristica fisica usando vari tipi di composti radiomarcati per evidenziare funzionalità del corpo; le quantità ridotte permettono indagini non invasive senza perturbazioni di natura farmacologica o tossicologica. In molti studi di Medicina Nucleare le quantità di traccianti impiegate sono dell'ordine di 10-9 g ed è evidente che nessuna altra tecnica fisica possa essere impiegata per rivelare quantità del genere. La misura, con sensibilità elevata, di processi biochimici e fisiologici costituisce la base fondamentale della Medicina Nucleare e la chiave del suo futuro sviluppo.
La tab.1.1 elenca alcune caratteristiche dei più comuni radionuclidi impiegati in studi diagnostici [Browne et al. 1986]; sono elencati i dati per i radionuclidi che decadono per cattura elettronica (EC 100%) o transizione isomerica (IT) con fotoni X e/o g di abbondanza superiore al 4%.
|
nucl. |
T1/2 |
modo |
Eg [keV] |
abbond. |
produzione |
|
Cr |
27.7 d |
EC |
|
|
Cr (n,g) 51Cr |
|
Co |
271 d |
EC |
|
|
Fe (d,n) 57Co |
|
Ga |
78 h |
EC |
|
|
Zn (p,2n) 67Ga |
|
Se |
120 d |
EC |
|
|
Se (n,g) 75Se |
|
Br |
56 h |
EC |
|
|
As (a,2n) 77Br |
|
Tcm |
6.0 h |
IT |
|
|
Mo (1) 99Tcm |
|
In |
2.8 d |
EC |
|
|
Cd (p,n) 111In |
|
Inm |
1.7 h |
IT |
|
|
Sn (n,g) 113Sn (2) 113Inm |
|
I |
60 d |
EC |
raggi X |
|
Xe (n,g) 125Xe (3) 125I |
|
Xe |
36.4 d |
EC |
|
|
I (p,n) 127Xe |
|
Yb |
32 d |
EC |
raggi X |
|
Yb (n,g) 169Yb |
|
Tl |
73 h |
EC |
raggi X |
|
Tl (p,3n) 201Pb (4) 201Tl |
b con T1/2 = 67 h (3) EC con T1/2 = 17 h
(2) EC con T1/2 = 117 d (4) EC con T1/2 = 9.3 h
tab.1.1 Alcune caratteristiche fisiche di radionuclidi di uso comune in studi diagnostici
Produzione di radionuclidi
I radionuclidi impiegati in Medicina Nucleare vengono prodotti con uno dei seguenti processi: (1) cattura neutronica, (2) fissione nucleare, (3) bombardamento con particelle cariche, (4) decadimento radioattivo.
Il primo processo sfrutta la reazione nucleare (n, g); per agire in modo efficiente è necessario eseguire irraggiamenti in pila di campioni di elevatissima purezza chimica sotto flussi neutronici elevati, generalmente termici. Un esempio è:
![]() [1.1]
[1.1]
Il secondo processo avviene nella reazione di fissione come, in particolare:
![]() [1.2]
[1.2]
Gli isotopi prodotti con tale metodo devono subire interventi di purificazione particolarmente complessi a causa della presenza di una notevole varietà di radionuclidi tra i prodotti della fissione.
Il terzo processo ha luogo quando un fascio di particelle cariche (H+, D+, 3He2+, 4He2+) colpisce un bersaglio costituito da atomi stabili. L'energia cinetica delle particelle deve essere sufficiente a superare la repulsione elettrostatica dei nuclei bersaglio. Un esempio è costituito dalla reazione:
![]() [1.3]
[1.3]
Per la produzione di radionuclidi di uso medico le energie delle particelle incidenti variano nell'intervallo 1 100 MeV. Uno dei maggiori vantaggi della produzione di radioisotopi tramite bombardamento di particelle cariche consiste nel fatto che l'isotopo prodotto è quasi sempre di diverso numero atomico rispetto agli atomi del bersaglio. Ciò permette teoricamente la generazione di radionuclidi con elevata attività specifica e minimi contenuti di impurità (legate comunque alla purezza del materiale di partenza ed alle sezioni d'urto della reazione desiderata e di altre reazioni secondarie). I radionuclidi prodotti con tale metodo sono prevalentemente a basso contenuto di neutroni e decadono con emissione di b o per cattura elettronica. Quest'ultima tipologia di radionuclidi è particolarmente utile nelle applicazioni cliniche a causa del decadimento privo di emissione di particelle cariche.
Il quarto processo, basato sul decadimento radioattivo, può portare alla formazione di nuclei stabili o instabili ed il nuovo nuclide può avere lo stesso o un differente numero atomico a seconda del tipo di decadimento. Il decadimento che dà luogo alla formazione di un nuclide figlio con Z diverso rende possibile una semplice separazione chimica tra genitore e figlio. Se il radionuclide figlio è idoneo all'uso per scopi medici, ed il genitore possiede vita media sufficientemente lunga da consentire la formazione, il trattamento e la spedizione del radionuclide figlio, allora questo processo di produzione può essere convenientemente adottato. Il dispositivo di produzione di radionuclidi per decadimento è detto generatore di radionuclidi e costituisce un modo di rendere disponibili sul posto prodotti a vita media breve. Il processo è basato sulla separazione chimica del radionuclide figlio dal genitore ottenuta normalmente con l'uso di tecniche cromatografiche [Yano 1975].
Un radionuclide molto diffuso in Medicina Nucleare è il 99Tcm che viene prodotto con un generatore 99Mo 99Tcm. Il 99Mo ha tempo di dimezzamento di circa 66 ore e può essere prodotto con attivazione neutronica oppure da fissione; esso decade in 99Tcm (85%) ed in 99Tc (15%). Il primo dei figli si trasforma, con tempo di dimezzamento di 6.02 ore, in 99Tc per transizione isomerica con emissione di raggi g di 140 keV (98%) non associati a particelle.
Radiofarmaci [Saha 1992]
Un radiofarmaco può presentarsi sotto forma di un radionuclide oppure come un composto radiomarcato; esso è impiegato per la diagnosi e il trattamento terapeutico di malattie umane. In Medicina Nucleare circa il 95% dei radiofarmaci è destinato a scopi diagnostici e tali sostanze non hanno in genere un effetto farmacologico poiché vengono somministrate in quantità molto piccole e quindi soltanto come traccianti.
Nella progettazione di un radiofarmaco il componente farmacologico viene scelto sulla base della sua localizzazione preferenziale in un certo organo oppure per la partecipazione alla sua funzione fisiologica. Il farmaco viene poi marcato con un opportuno radionuclide in modo che, dopo la somministrazione, le radiazioni emesse possano essere rivelate dal sistema di misura. Dal punto di vista farmacologico la sostanza deve presentare le necessarie caratteristiche di sicurezza e non tossicità, mentre dal punto di vista fisico le radiazioni emesse devono essere facilmente rivelabili dalla strumentazione e la dose di radiazioni somministrata al paziente deve essere minima. Un radiofarmaco ideale deve presentare i seguenti requisiti:
(a) accessibilità: semplicità del processo produttivo, basso costo, disponibilità nei luoghi in cui si esercita Medicina Nucleare (per es. la distanza geografica tra utente e fornitore limita di fatto l'utilizzo di radiofarmaci a vita breve);
(b) basso tempo di dimezzamento effettivo: poiché la quantità di un farmaco presente in un organismo segue una legge esponenziale con tempo di dimezzamento biologico Tb, si ha che la quantità di un sostanza radioattiva presente nel medesimo organismo segue un andamento temporale decrescente, con tempo di dimezzamento effettivo Te tale che:
![]() [1.4]
[1.4]
dove Tr è il tempo di dimezzamento del radionuclide. Il radiofarmaco ideale deve presentare il minor Te possibile compatibilmente con l'intervallo di tempo minimo richiesto per l'inizio dell'analisi (determinato dal processo di captazione) e con il tempo di durata della medesima. Quest'ultima dipende comunque dalla quantità di radionuclide somministrata, dalla frazione accumulata nell'organo in studio e dall'efficienza di captazione nei tessuti. Una grandezza importante da tenere presente nella scelta del compromesso migliore è l'attività specifica (riferita all'unità di massa di radiofarmaco) il cui valore non può essere troppo elevato per limitare a livelli accettabili l'effetto di radiolisi del radiofarmaco;
(c) minima emissione di particelle cariche: l'emissione di particelle ionizzanti all'atto del decadimento del radionuclide provoca un maggior danno da radiazioni ai tessuti attraversati rispetto al caso dei fotoni g puri
(d) alta frazione assorbita nell'organo in esame: negli studi diagnostici è preferibile che il radiofarmaco venga captato con elevata efficienza nell'organo considerato poiché i fotoni provenienti dagli organi vicini interferiscono anche in modo rilevante con quelli della regione di interesse; come ricordato in (b) il radiofarmaco deve essere dotato di spiccate capacità selettive rispetto alla captazione nei tessuti malati.
ANGER-CAMERA
Cenni storici
I primi studi per la produzione di immagini con radionuclidi sono realizzati impiegando un rivelatore a scintillazione accoppiato ad un collimatore focalizzante di piombo. Il metodo consente di rivelare in modo efficiente i soli fotoni X o g provenienti da una regione limitata dell'oggetto, localizzata in prossimità del fuoco del collimatore stesso. Eseguendo una scansione rettilinea lungo il corpo in esame si può costruire un'immagine corrispondente alla distribuzione di attività del radiofarmaco all'interno dei tessuti. Negli anni 1950 vengono sviluppati dispositivi di scansione rettilinea con rivelatori costituiti da uno o due cristalli scintillanti NaI(Tl) contrapposti e di grandi dimensioni ciascuno dei quali è accoppiato ad un collimatore di piombo; con tali sistemi vengono eseguiti studi delle distribuzioni di 18F, 51Cr, 131I, 198Au e 59Fe [Beck 1964]. Anche se la rivelazione dei fotoni viene effettuata con sensibilità ragionevolmente elevata, tali sistemi usano in modo poco efficiente la dose di radiofarmaci somministrata al paziente a causa del brevissimo tempo di acquisizione dedicato ad ogni particolare del corpo.
Con lo sviluppo della tecnologia si registra la realizzazione di dispositivi di produzione di immagini stazionarie costituiti da molti cristalli scintillanti accoppiati. Uno di tali sistemi, realizzato dalla Baird Atomics Inc a metà degli anni 1960, è costituito da un grande numero di cristalli sottili NaI(Tl) accoppiati a matrice rettangolare e collegati con guide di luce di materiale plastico a due distinti banchi di fototubi per la identificazione della posizione di incidenza del singolo fotone [Bender et al. 1963].
Lo sviluppo di cristalli NaI(Tl) sottili e di grande area porta infine ad un radicale cambiamento con l'invenzione dell'Anger-camera [Anger 1958, 1964, 1966]. Essa è costituita da un singolo cristallo di grande area accoppiato ad un collimatore di piombo multi-fori, con assi perpendicolari alla superficie, che definisce i percorsi dei fotoni ottenendo immagini in scala 1:1 di interi organi del corpo. Opportuni circuiti elettronici analogici, capacitivi o resistivi, di accoppiamento con molti fototubi, posti otticamente in contatto con la superficie interna del cristallo scintillante, determinano le coordinate planari di interazione del fotone nello scintillatore. Dispositivi con diametri fino a 50 cm sono dedicati allo studio di grandi organi e dell'intero corpo e, per la prima volta, è possibile la produzione di immagini dinamiche relative alla distribuzione di radiofarmaci. Poiché la risoluzione spaziale della camera è dell'ordine di 1 2 cm in profondità e raggiunge valori di 0.4 cm vicino alla superficie del collimatore, la Anger-camera apre per la prima volta il campo alla possibilità di applicazioni in alta risoluzione spaziale.
I cristalli sottili di NaI(Tl) di grande area presentano alta sensibilità per basse energie dei fotoni (100 200 keV) ma diventano rapidamente meno sensibili sopra i 300 keV. La buona risoluzione energetica del sistema consente inoltre di effettuare spettrometria, separando quindi in modo abbastanza efficiente i contributi non dovuti alle interazioni fotoelettriche. La tendenza all'uso di cristalli sottili ( 6 mm) per migliorare le risoluzioni spaziali ne indirizza l'uso al campo dei fotoni g di bassa energia con l'effetto di sollecitare lo sviluppo di nuovi specifici radiofarmaci ( 99Tcm, 123I, 111In, 201Tl ).
Descrizione di un'Anger-camera
Una moderna Anger-camera (fig.2.1) è costituita da: (1) un collimatore multi-fori; (2) un cristallo NaI(Tl) di grande area; (3) una guida di luce per l'accoppiamento ottico della matrice esagonale di fototubi al cristallo; (4) un modulo elettronico analogico per la determinazione della posizione di incidenza del fotone; (5) un modulo elettronico per l'analisi di ampiezza degli impulsi; (6) uno schermo di piombo di spessore adeguato a ridurre il contributo del fondo presente nell'ambiente [Short 1984].
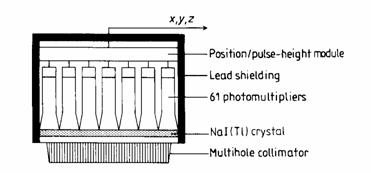
fig.2.1 Componenti di base di una gamma camera
I necessari dettagli riguardanti la teoria dei rivelatori a scintillazione sono esposti in appendice A, mentre le considerazioni in materia di limiti per la risoluzione spaziale sono esposte estesamente in appendice B.
Collimatori [Webb 1993]
Il sistema di collimazione ha lo scopo di selezionare la direzione dei fotoni incidenti nella camera; nel caso del collimatore a fori paralleli (fig.2.2) solo quelli che entrano perpendicolarmente alla superficie della camera possono raggiungere il cristallo. Il collimatore definisce geometricamente il campo visuale della camera e contribuisce a determinarne le caratteristiche di risoluzione spaziale e di sensibilità.
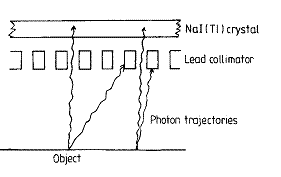
fig.2.2 Schema di un collimatore a fori paralleli
Un'Anger-camera ha in dotazione dei collimatori a fori paralleli di caratteristiche diverse da impiegare a seconda dell'energia dei fotoni e per ottenere il miglior compromesso tra risoluzione spaziale e sensibilità (tab.2.1). Sono disponibili inoltre collimatori ad ingrandimento per la generazione di immagini di piccoli organi superficiali e collimatori a fori convergenti o divergenti adatti per l'intero corpo e per organi di medie e grandi dimensioni.
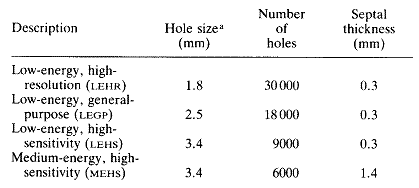
tab.2.1 Caratteristiche tipiche di collimatori a fori paralleli per una gamma camera F = 40 cm.
(a): diametro del foro o distanza tra i lati dell'esagono
Per i collimatori a fori paralleli è possibile esprimere risoluzione spaziale ed efficienza geometrica in funzione di alcuni parametri dimensionali. Se L è la lunghezza dei fori, d il loro diametro e z la distanza sorgente-collimatore, per la risoluzione spaziale del collimatore si può scrivere:
![]() [2.1]
[2.1]
Quindi Rc migliora aumentando la lunghezza dei fori oppure aumentandone il numero per unità di superficie (e mantenendo un adeguato spessore dei setti) in modo che un maggior numero di fori di minor diametro possa essere alloggiato nella stessa area totale. Inoltre c'è da notare che la risoluzione spaziale può essere migliorata anche riducendo la distanza sorgente-collimatore.
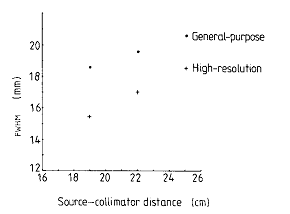
fig.2.3 Variazione della risoluzione spaziale con la distanza sorgente-rivelatore per un collimatore a fori paralleli
Il grafico di fig.2.3 mostra che la risoluzione spaziale del collimatore peggiora con l'aumentare della distanza sorgente-rivelatore. Per l'efficienza geometrica g del collimatore si può scrivere:
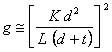 [2.2]
[2.2]
dove t è lo spessore del setto e K è una costante che dipende dalla forma dei fori (p. es. K = 0.26 per sezioni esagonali in una matrice esagonale). Si noti che g è indipendente dalla distanza sorgente-collimatore per una sorgente puntiforme in aria poiché la legge dell'inverso del quadrato è compensata dall'area esposta del rivelatore. La tab.2.2 riporta le caratteristiche di alcuni collimatori a fori paralleli disponibili in commercio.
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2024