|
|
| |
Il cuore
Il cuore è un organo cavo a parete muscolare situato nella cavità mediastinica tra i polmoni. Presenta quattro cavità: due ventricoli e due atri comunicanti in verticale per mezzo di una valvola tricuspide a dx e mitrale a sx. La massa del cuore è in media di 300gr nel maschio e di 250gr nella femmina, in generale rappresenta lo 0,45-0,40% della massa corporea espressa in grammi. Da ciascun ventricolo origina un grosso vaso arterioso: l'aorta dal ventricolo sx, l'arteria polmonare dal dx. Dall'aorta ori 959f51j gina il circolo sistemico che ritorna al cuore attraverso due vene cave sfocianti nell'atrio dx. L'arteria polmonare porta il sangue ad irrorare i polmoni dai quali, a scambi gassosi avvenuti, ritorna al cuore attraverso le vene polmonari, due da ciascun polmone, sfocianti nell'atrio sx. Il circuito che il sangue compie è duplice:
-circolo sistemico o grande circolo dall'atrio sx, attraverso la valvola mitrale, al ventricolo sx e da questo agli organi periferici attraverso aorta, arterie, arteriose e capillari, ove hanno sede gli scambi a livello cellulare. Da qui attraverso le venule, vene e le due vene cave il sangue torna all'atrio dx
-circolo polmonare o piccolo circolo dall'atrio dx, attraverso la valvola tricuspide, al ventricolo dx e da questo, attraverso l'arteria polmonare e le sue diramazioni, ai capillari polmonari ove hanno sede gli scambi gassosi. Da qui attraverso venule e vene polmonari il sangue ritorna all'atrio sx. L'aorta e l'arteria polmonare sono dotate di valvole denominate aortica e polmonare.
L'azione del cuore è ritmica, la sua muscolatura si contrae e si rilascia alternativamente e in modo coordinato nel corso di un ciclo cardiaco. Mediante tale azione il cuore fornisce al sangue la pressione necessaria a farlo scorrere. La contrazione e il rilasciamento sono capacità intrinseche nel muscolo costituente le pareti delle cavità cardiache. La contrazione è avviata da cellule muscolari cardiache, specializzate e raggruppate in una struttura, il nodo del seno (SA) localizzata nella parete dell'atrio dx. Tre fasci presenti nella parete dell'atrio dx trasportano l'impulso dal nodo SA a una struttura di raccolta, il nodo atrioventricolare (AV), situata nella parete posteriore dx del setto interatriale. Lo stimolo è trasmesso al rimanente miocardio funzionale dal sistema di conduzione costituito dal fascio di His che si suddivide in due branche ventricolari che decorrono lungo le due facce del setto interventricolare e si sfioccano nelle fibre di Purkinje, che prendono contatto con le cellule miocardiche.
Le cellule del miocardio sono saldate tra loro attraverso dischi intercalari costituiti da zone di membrana cellulare adiacenti e interdigitate tra loro al fine di garantire efficaci connessioni meccaniche ed elettriche: sinapsi elettriche. Ciò contraddistingue il miocardio dal tessuto muscolare scheletrico che è organizzato in unità motorie e la cui attivazione avviene attraverso un impulso nervoso trasmesso a livello di una ristretta zona differenziata, la placca motrice, che è una sinapsi di natura chimica. La cellula miocardia è delimitata da una membrana con caratteristiche morfologiche e proprietà funzionali peculiari. Il citoplasma è differenziato in tubuli e vescicole, delimitati da membrane costituenti nel loro insieme il sistema sarcotubulare, e in strutture fibrillari contrattili, simili a quelle presenti nel tessuto muscolare scheletrico. Si può distinguere una tripla partizione:
-un ambiente in cui è presente il LEC (liquido extracellulare), esterno alla miocellula, e il cui confine è rappresentato dal sarcolemma
-un ambiente interno alla cellula ma separato dagli altri costituenti cellulari del sistema sarcotubulare, il quale contiene un liquido in cui si trovano ioni e altre sostanze in concentrazioni diverse da quelle del citosol nel quale è immerso
-un sistema miofibrillare e i mitocondri a esso associati, tale organizzazione mantiene differenze di concentrazione ionica tra l'interno e l'esterno della miocellula. Ciò costituisce la differenza di potenziale elettrico rilevabile, a riposo, tra l'interno e l'esterno della cellula miocardia pari a -80 mV, con l'interno negativo rispetto all'esterno
Tenendo presente che esiste una differenza di potenziale tra i due lati del sarcolemma è evidente che il potenziale a riposo rappresenta una situazione termodinamicamente improbabile, in quanto il Na tenderebbe ad entrare nella cellula secondo i gradienti elettrici e di concentrazione mentre il K tenderebbe ad uscire seguendo il gradiente di concentrazione. Ciò implica meccanismi di membrana che mantengano tale squilibrio consumando energia, questi meccanismi sono identificabili in complessi proteici di membrana che, nel caso specifico, si incaricano di spostare nel LEC gli ioni di sodio che penetrano all'interno della cellula attraverso uno scambio con gli ioni potassio che ne fuoriescono. Tali complessi sono denominati pompe e, nel caso specifico, pompa Na/K, caratterizzata da effetti elettrogenici, dato che l'estrusione dalla cellula di tre ioni Na è concomitante all'ingresso di due ioni K, con conseguente bilancio negativo di cariche positive al suo interno. Tale azione richiede un dispendio energetico che si realizza attraverso un effetto Na/K-ATPasico. Per potersi contrarre la cellula miocardica deve sviluppare un potenziale d'azione. Ciò significa che ciascuna cellula miocardica deve andare incontro a una serie rapida e stereotipata di eventi in seguito ai quali il potenziale di membrana cadrà verso un valore più basso e vi resterà per qualche tempo finchè non sarà ripristinato lo stato antecedente il potenziale d'azione. Le fasi sono:
-depolarizzazione rapida
-plateau
-ripolarizzazione
Gli eventi alla base di questa sequenza sono identificabili in rapide e transitorie variazioni delle conduttanze di membrana di alcune specie ioniche. Nel caso della cellula miocardica agli ioni va aggiunto il Ca, le cui variazioni di conduttanza sono responsabili della fase di plateau del potenziale d'azione. Il potenziale dazione della cellula miocardica è una caratteristica peculiare della cellula stessa. Potenziali d'azione possono insorgere nelle cellule ventricolari, spontaneamente e al di fuori del controllo del nodo SA, con battiti ectopici ventricolari (BEV). L'azione di pompa del cuore richiede una coordinazione dei movimenti delle singole cellule miocardiche, che può essere garantita dall'esistenza di una rigida "gerarchia" tra la sede di generazione dell'impulso cardiaco, le vie di trasmissione dello stesso e l'azione meccanica ventricolare. Il potenziale d'azione del nodo SA si diffonde al miocardio attraverso le vie di conduzione. Allorché l'impulso giunge a livello dei singoli miociti è trasmesso al loro interno dal sistema T. questo sistema è costituito da profonde invaginazioni tubuliformi del sarcolemma che si affacciano alla parte terminale e dilatata delle cisterne sarcoplasmatiche, costituenti la miofibrilla. Non esiste comunicazione diretta tra l'interno dei tubuli T e quello delle cisterne sarcoplasmatiche, ciascun tubulo T corrisponde a una stria Z delle unità sarcomeriche costituenti la miofibrilla. Il potenziale d'azione si diffonde da una cellula muscolare alla successiva attraverso i dischi intercalari, costituiti da porzioni affacciate del sarcolemma di ciascuna delle due cellule miocardiche in modo da assicurare sia la coesione meccanica sia la connessione elettrica tra i due elementi cellulari, consentendo la trasmissione del potenziale d'azione. La generazione dell'impulso avviene nella zona pacemaker del nodo SA, ciò avviene in 5 fasi:
-FASE 0 caratterizzata da rapida depolarizzazione in cui il potenziale di membrana supera il livello di 0 mV. Questa rapida depolarizzazione è dovuta a un rapido aumento della permeabilità della membrana agli ioni Na. Si verifica anche una riduzione della permeabilità della membrana per il K rispetto ai livelli di riposo.
-FASE 1 caratterizzata da una prima fase di ripolarizzazione dovuta all'apertura dei canali per il K.
-FASE 2 si aprono i canali per il calcio che bilanciano l'uscita di K. Il potenziale rimane costante. Verso la fine di questa fase la permeabilità del Ca si riduce e la permeabilità del K aumenta.
-FASE 3 si chiudono i canali per il Ca mentre quelli del K rimangono aperti. In questa fase la cellula viene ripolarizzata. Il potenziale di membrana torna al suo valore iniziale e rimane stabile fino al potenziale d'azione successivo.
-FASE 4 è il periodo in cui il potenziale di membrana rimane stabile.
Le varie fasi del potenziale d'azione cardiaco sono associate a periodi di refrattarietà, che precisamene sono:
-periodo di refrattarietà assoluto il muscolo non può essere stimolato nuovamente
-periodo di refrattarietà relativo
-periodo di eccitabilità super-normale il muscolo si stimola più facilmente perché la permeabilità al K risulta ancora inferiore alla norma. Il potenziale d'azione che risulta in questa fase è di ampiezza inferiore alla norma perché non tutti i canali di Na hanno recuperato la capacità di attivarsi nuovamente.
Le cellule del seno hanno il compito di avviare l'attività cardiaca (pacemaker naturale) e dato che non esistono a livello cardiaco sinapsi neuromuscolari vi dovrà essere un altro modo per dare origine al potenziale d'azione avviatore. Il meccanismo consiste nel fatto che le cellule del nodo SA non hanno un potenziale di riposo stabile, vi è una spontanea tendenza alla depolarizzazione fino al raggiungimento del valore soglia oltre il quale il potenziale d'azione segue spontaneamente il suo decorso. Non vi sono né un potenziale rapido all'inizio né un evidente periodo di plateau. Il potenziale a riposo delle cellule pacemaker presenta una pendenza positiva che porterebbe in nodo SA a una frequenza intrinseca di scarica pari a 100-110 battiti/min. Vi deve essere un meccanismo di regolazione che consenta alla frequenza cardiaca di stabilizzarsi a riposo su un valore che è al di sotto di quello intrinseco e di elevarsi di più di tre volte al di sopra del valore a riposo nel soggetto giovane. Ciò è ottenuto mediante l'azione del sistema nervoso autonomo che innerva il cuore con le sue due branche, simpatica e parasimpatica, garantendo l'azione regolatrice sia della frequenza (azione cronotropa) sia della forza di contrazione (azione inotropa).
-parasimpatico attraverso le terminazioni del nervo vago a livello degli atri innerva il nodo SA e il nodo AV e controlla la frequenza con effetto inibitore. La frequenza cardiaca di 60 battiti/min è indice di ipertono vagale, quindi il parasimpatico ha azione cronotropa negativa.
-simpatico innerva atri e ventricoli garantendo un'azione cronotropa e inotropa positiva per un aumento sia della frequenza sia della forza di contrazione.
Poiché la forza di contrazione è depressa dal SN colinergico, si dice che questo ha azione inotropa negativa. Le terminazioni nervose dei due sistemi antagonisti si suddividono tra le fibrocellule muscolari la cui membrana possiede recettori specifici per i neuromediatori rilasciati dai nervi. Vi sono recettori b-adrenergici cui si lega la noradrenalina e recettori muscarinici per l'acetilcolina.
Accoppiamento eccitazione-contrazione nella cellula miocardica
L'arrivo del potenziale d'azione a livello delle cellule miocardiche da luogo a una serie di eventi elettrici e meccanici che sfociano nella contrazione del miocardio a cui segue rilasciamento. Il potenziale d'azione si propaga lungo la membrana cellulare e giunto ai Tubuli T viene da questi trasmesso in profondità alle prospicienti porzioni del reticolo sarcoplasmatico. Ciò determina il rilascio di ioni di Ca dalle cisterne del reticolo sarcoplasmatico nel citosol. La concentrazione intracellulare di Ca libero è incrementata da 0,1 mM a 100 mM. L'aumento della concentrazione di Ca nel citoplasma è determinato da un afflusso di Ca dal LEC. Si innescano una serie di interazioni tra le molecole costituenti il sistema miofibrillare. Il calcio si lega alla Troponina C, ciò determina uno spostamento della tropomiosina con conseguente scopertura dei siti di legame tra actina e miosina. Le teste di miosina si possono così legare all'actina e, con consumo di ATP, si verifica il movimento di piegatura delle molecole di miosina e lo scorrimento reciproco dei filamenti di actina e miosina. ciò determina l'accorciamento del sarcomero e la contrazione del miocardio. A contrazione avvenuta, attraverso la ripolarizzazione è ripristinato lo status quo ante della fibrocellula e il Ca è riportato all'interno del reticolo sarcoplasmatico. La lunga durata del potenziale d'azione e la lunga durate del periodo refrattario assoluto fanno si che il miocardio non possa sviluppare contrazioni tetaniche che avrebbero esisti disastrosi. Nel caso in cui sia richiesto un incremento della forza contrattile, la struttura sincinziale del miocardio non consente un reclutamento di nuove unità cellulari alla sforzo comune. Tutto il tessuto miocardico è coinvolto nel corso di una contrazione dato che non vi sono unità motrici. Il meccanismo attraverso il quale il miocardio fa fronte alla richiesta di aumento dell'output meccanico si basa sull'aumento della quantità di Ca che è rilasciata dal potenziale d'azione. Un aumento della contrattilità è garantito attraverso un aumento della quantità di Ca che si rende disponibile per la creazione dei ponti actina-miosina.
Ciclo cardiaco
-FASE 1 pre-onda P depolarizzazione: la pressione è molto bassa, il sangue proveniente dalle vene polmonari riempie l'atrio sx
-FASE 2 riempimento veloce: la pressione atriale è ancora più bassa rispetto a quella presente a livello polmonare, la valvola è aperta
-FASE 3 onda P depolarizzazione atri: parte l'impulso, avviene la sistole. Si apre la mitrale, l'atrio si contrae, la pressione sale, il volume raggiunge il massimo telediastolico o diastole
-FASE 4 complesso QRS depolarizzazione ventricoli: aumento della pressione fino a superare quella atriale, la mitrale si chiude
-FASE 5 eiezione veloce: la pressione ventricolare sale fino a permettere l'apertura dell'aorta
-FASE 6 eiezione lenta: il sangue passa nell'aorta, la pressione scende, si interrompe la contrazione, viene chiusa la semilunare
-FASE 7 onda T rilasciamento: tutte le valvole sono chiuse, la pressione scende
Il ciclo cardiaco è costituito da una serie coordinata di eventi elettrici e meccanici che consentono al cuore di svolgere l'azione di pompa. Possono essere descritti secondo due modelli prinicipali:
curva pressione-volume dei ventricoli
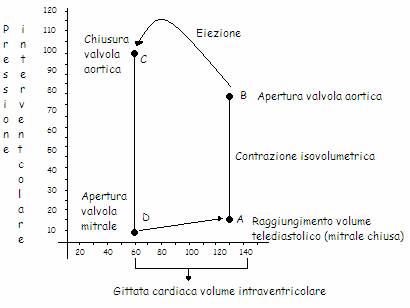
Il ventricolo sx contiene 130ml di sangue, 70 dei quali vi sono penetrati nel corso della diastole, provenendo dall'atrio sx avendo attraversato la valvola mitrale. A questo punto inizia la contrazione sistolica. Nel corso della prima fase della sistole, la parete ventricolare si contrae isometricamente. Appena inizia la contrazione, la valvola a monte del ventricolo, la valvola mitrale, si chiude interrompendo la comunicazione con l'atrio e rendendo impossibili eventuali rigurgiti di sangue. La valvola a valle del ventricolo, che lo pone in comunicazione con l'aorta, non si è ancora aperta, né si aprirà fino a quando la tensione sviluppata dalla parete ventricolare non avrà superato la pressione diastolica vigente in aorta. La linea dal punto A al B descrive il continuo aumento della pressione ventricolare in corrispondenza di un unico valore di volume. La contrazione è definita isovolumetrica. Al punto B si verifica l'apertura della valvola aortica e il sangue fluisce sotto la spinta ventricolare nel bulbo aortico. La contrazione ventricolare nel corso dell'azione di propulsione del sangue in aorta non è isotonica. La pressione aumenta con decorso curvilineo fino al valore sistolico per poi decrescere fino al punto C. Tale andamento è giustificato dalla relazione intercorrente tra pressione, tensione parietale e raggio di curvatura della camera ventricolare e dalla relazione tensione-lunghezza delle fibre miocardiche. Al punto C cessa la sistole, l'azione propulsiva ventricolare (telesistole). Questo porterebbe il sangue a rifluire nel ventricolo se ciò non fosse impedito dalla chiusura della valvola aortica. Il valore di pressione leggibile al punto C risulta intermedio tra i valori di pressione diastolica e sistolica. Corrisponde all'incisura dicrota del tracciato della pressione aortica in funzione del tempo. Al punto C la pressione endocavitaria cade verticalmente fino al punto D, dal momento che il miocardio parietale si rilascia. È la fase di rilasciamento isovolumetrico della diastole. Il valore di volume corrisponde al punto D è quello minimo raggiunto dal ventricolo alla fine della sistole (volume telesistolico). È quello da cui inizia il riempimento diastolico per il ciclo successivo. In corrispondenza del punto D si riapre la valvola mitrale permettendo il flusso di sangue dall'atrio sx al ventricolo sottostante. Il sangue è spinto dall'atrio al ventricolo sottostante da un gradiente pressorio limitato a pochi mmHg che si viene a formare per la contemporanea distensione dell'atrio, dovuta al ritorno venoso, e il rilasciamento ventricolare. A riposo, la sistole striale contribuisce al riempimento ventricolare in misura pari al 10-30% e non in maniera sostanziale. La curva si riferisce al ventricolo sx. Per quanto concerne il dx i fenomeni sono del tutto simili, cambiano solo i valori pressori: la pressione sistolica del circolo polmonare è di circa 24mmHg, mentre quella diastolica è di 8mmHg. I volumi ventricolari in gioco a dx e sx sono uguali, esiste una corrispondenza quantitativa precisa tra il flusso ematico del circolo polmonare e quello del circolo sistemico. Il precarico corrisponde al valore di pressione leggibile in corrispondenza del volume ventricolare telediastolico (punto A). Per calcolare le forze in gioco a livello della parete ventricolare è possibile utilizzare la forma semplificata dell'equazione di La Place:
T tensione parietale media
2T=P*r P pressione venticolare endocavitaria
r raggio ventricolare
Partendo dalle condizioni iniziali, nel corso del riempimento diastolico la tensione parietale aumenta, in proporzione all'aumento del volume ventricolare fino al raggiungimento dei valori telediastolici. La pressione endocavitaria corrisponde al valore telediastolico. La fase iniziale della sistole coincide con la contrazione isovolumetrica del miocardio parietale. In proporzione, tale aumento è maggiore del corrispondente aumento della pressione endocavitaria. Il fattore di guadagno è rappresentato dall'aumento del raggio del ventricolo (P=2T/r). La pressione endocavitaria aumenta fino a raggiungere il valore della pressione diastolica vigente in aorta. Segue la fase eiettiva della sistole, durante la quale il raggio di curvatura del ventricolo diminuisce fino a raggiungere il volume telesistolico. Nel corso dell'eiezione fino al raggiungimento della pressione sistolica, persistendo la contrazione della muscolatura parietale, la pressione endocavitaria aumenta in proporzione con la diminuzione del raggio ventricolare. Si ha un guadagno pressorio a spese del raggio di curvatura del ventricolo. L'inizio della diastole coincide con il rilasciamento isovolumetrico della parete ventricolare. Alla fine del rilasciamento isovolumetrico il volume ventricolare avrà raggiunto il suo valore protodiastolico. Tensione parietale, pressione endocavitaria e raggio di curvatura saranno tornati ai valori iniziali del ciclo.
-Effetti delle variazioni del precarico ventricolare-"Legge del cuore" di Frank-Starling: entro i limiti definiti, la contrazione della muscolatura miocardica nel corso della sistole è tanto più efficace quanto più il ventricolo si è riempito di sangue nel corso della diastole. La gittata sistolica aumenta in proporzione al ritmo venoso al cuore e, conseguentemente, al riempimento ventricolare. Un aumento del precarico ventricolare è seguito da un aumento della gittata sistolica, dato che si è verificato un allungamento delle fibre miocardiche che precede la contrazione. Si tratta di un meccanismo di regolazione della gittata cardiaca definito autoregolazione eterometrica.
-Effetti delle variazioni del postcarico ventricolare:l'inizio della fase eiettiva della sistole ventricolare coincide con il momento in cui la pressione ventricolare supera il valore della pressione diastolica vigente in aorta. Il postcarico è il valore diastolico della pressione aortica e sistemica. È possibile predire gli effetti di una variazione della pressione aortica, o sistemica, sulla funzione ventricolare. Un aumento della pressione arteriosa sistemica, inteso come aumento del postcarico, in assenza di meccanismi di compenso determina una riduzione della gittata sistolica. Il limite superiore della curva pressione-volume del ventricolo è rappresentato da una curva analoga a quella della tensione isometrica massima. In caso di aumento della richiesta di prestazione cardiaca la noradrenalina rilasciata a livello miocardico dalle terminazioni del SNA simpatico determina uno spostamento della curva. Tale situazione è definita incremento dello stato inotropo del miocardio. L'azione della noradrenalina sul miocardio è cronotropa e inotropa positiva. L'incremento dello stato inotropico del miocardio, per azione del simpatico, è verificabile sulla base dello spostamento verso l'alto della curva pressione ventricolare-gittata sistolica che descrive la legge di Frank-Starling. L'azione di pompa del cuore ha come scopo il mantenimento di una gittata cardiaca adeguata alle richieste metaboliche dell'organismo, si può riassumere il complesso sistema di interazioni che la regolano come il gioco di tutti i fattori in grado di intervenire sull'equazione:
Q gittata cardiaca
Q = FC * qc FC frequenza cardiaca (battiti*min-1)
qc gittata sistolica ventricolare (ml)
Il SNA parasimpatico ha azione cronotropa negativa (riduzione FC) mentre il SNA simpatico esercita un'azione cronotropa positiva (aumento FC). L'attività del simpatico ha un effetto inotropo positivo sulla contrattilità con conseguente aumento di qc. Fattori esterni al cuore in grado di influire su Q sono:
-pressione arteriosa (postcarico), il cui aumento porta a diminuzione di Q
-pressione di riempimento ventricolare (precarico), il cui aumento determina un aumento di Q in base al meccanismo di Frank-Starling
Il sangue fluisce agli atri e hai ventricoli nel corso di tutta la sistole. Le valvole aortica e polmonare sono chiuse mentre sono aperte le valvole atrioventricolari tricuspide e mitrale. In prossimità della telediastole la velocità di riempimento ventricolare diminuisce, questi infatti hanno raggiunto un elevato grado di distensione essendosi riempiti, passivamente, per oltre il 70%. Il riempimento dei ventricoli è completato dalle sistoli atriali che hanno un ruolo poco significativo a riposo. Le vene tributarie degli atrisono sprovviste di valvole per prevenire il rigurgito di sangue nel corso delle sistoli atriali. L'inizio della sistole coincide con la chiusura delle valvole ventricolari, la pressione endocavitaria sale repentinamente nell'arco di 50ms nel corso della contrazione ventricolare isovolumetrica. Allorché i ventricoli raggiungono e superano la pressione diastolica dei vasi arteriosi si ha l'apertura delle rispettive valvole aortica e polmonare. Ciò coincide con la fase eiettiva della sistole. Nel corso di tale fase ciascun ventricolo sviluppa la massima pressione, che sarà di circa 120mmHg a sx e di circa 25mmHg a dx. Poiché nel corso della sistole i lembi delle valvole atrioventricolari sono stirati verso il basso a causa della contrazione ventricolare, la pressione all'interno degli atri diminuisce. Nel corso dell'eiezione ventricolare ciascun ventricolo espelle, a riposo, un volume di sangue pari a 70-90ml. Considerando il volume che i ventricoli avevano raggiunto alla fine della diastole, ciò corrisponde al 65% del volume telediastolico (frazione di eiezione). Alla fine della sistole rimangono nei ventricoli circa 50ml di sangue (volume telesistolico). Avendo raggiunto la muscolatura ventricolare il massimo grado di contrazione, inizia ora una nuova diastole. Il punto di inizio coincide con la chiusura delle valvole aortica e polmonare. In un tempo di 40ms la pressione endocavitaria di ciascun ventricolo cade a un valore che è inferiore a quello della pressione dell'atrio sovrastante: è la fase di rilasciamento isovolumetrico dei ventricoli. Ciò comporta l'apertura delle valvole atrioventricolari e l'avvio di un nuovo ciclo con l'inizio del riempimento ventricolare. Le rispettive durate della sitole e della diastole dipendono dalla frequenza cardiaca. Nel corso della diastole si ha il ristoro miocardico. Il flusso ematico coronarico del ventricolo sx è un flusso eminentemente diastolico. Sotto il profilo emodinamico, solo un'adeguata durata della diastole consente il riempimento ventricolare e un aumento della gittata cardiaca in grado di soddisfare condizioni metaboliche più impegnative.
Toni cardiaci alcuni eventi meccanici possono essere rilevati all'esterno mediante l'uscultazione operata con l'uso di un fonendoscopio appoggiato su opportuni punti del torace che costituiscono i punti di repere dei toni cardiaci. La chiusura delle valvole cardiache da luogo a rapide transizioni del regime di flusso del sangue da laminare a turbolento.
-I° tono è dato dalla chiusura delle valvole mitrale e tricuspide e dura circa 150ms
-II° tono coincide con la chiusura delle valvole aortica e polmonare, dura 120ms. Può essere sdoppiato nel corso dell'inspirazione, allorché si desincronizzano le chiusure delle valvole
Le variazioni di pressione endotoracica nel corso del ciclo respiratorio sono in grado di influire sui tempi di riempimento e di svuotamento della metà destra del cuore. In caso di difetti valvolari, dovuti a patologie per lo più di tipo infiammatorio si possono udire soffi. Le valvole possono offrire maggior resistenza al flusso a causa di stenosi o non chiudersi perfettamente, dando luogo a rigurgiti.
-soffi sistolici si verificano in caso di stenosi delle valvole aortica e/o polmonare e di insufficienza delle valvole atrioventricolari
-soffi diastolici si verificano in caso di insufficienza delle valvole aortica e/o polmonare e di stenosi delle valvole atrioventricolari
diagramma di Wiggers descrive per ciascuna metà del cuore l'andamento sincrono di vari parametri quali l'elettrocardiogramma, le pressioni endocavitarie e i volumi di atrio e ventricolo, lo sfigmogramma e il flusso aortico o polmonare e il fonocardiogramma.
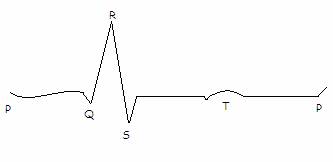
-onda P onda di depolarizzazione atriale
-QRS complesso rapido ventricolare corrispondente alla depolarizzazione dei ventricoli
-onda T onda di ripolarizzazione ventricolare.
Energetica cardiaca
Il miocardio si contrae sfruttando l'energia che si libera dalla scissione dell'ATP secondo la relazione:
ATP H2O = ADP Pi energia
L'ATP consumato deve essere ricostituito. Ciò si verifica mediante la fosforilazione ossidativa che avviene a livello mitocondriale. Vengono ossidati substrati energetici diversi, quali i carboidrati, gli acidi grassi liberi, i trigliceridi, i corpi chetonici e l'anione lattato, che entrano nel ciclo di krebs attraverso la via dell'acetil-CoA. Vi è pertanto consumo di O2 (Vo2), produzione di CO2 e acqua e liberazione di energia che viene immagazzinata sotto forma di nuove molecole di ATP. Il miocardio non è capace di utilizzare la glicolisi anaerobia per la risintesi dell'ATP. Ne consegue che il metabolismo miocardico dipende da un'adeguata e continua fornitura di O2. ciò è testimoniato dalla notevole ricchezza dell'apparato mitocondriale delle fibrocellule miocardiche e dal loro contenuto di miogloina. L'O2 è fornito al miocardio dal circolo coronarico. L'efficienza di tale circolo rappresenta un fattore critico perché la capacità del miocardio di estrarre O2 dall'emoglobina è molto spiccata. A riposo il contenuto di O2 nel sangue venoso refluo del miocardio è pari a 5ml/dl di sangue. L'incremento delle richieste di O2 da parte del miocardio possono essere soddisfatte soltanto attraverso un adeguato incremento della perfusione coronarica. Il consumo di O2 del cuore (MVO2) battente, a riposo, è di 9ml O2/min-1/100gr di tessuto miocardico. La frazione di MVo2 necessaria al metabolismo basale miocardico ammonta al 19%. L'energia necessaria all'attività elettrica rende conto di un altro 0,05%. Il restante 80% del MVO2 è suddiviso tra frequenza cardiaca, sviluppo della tensione parietale e livello di inotropismo. La spesa energetica dovuta alla contrazione isovolumetrica è legata al postcarico, alla pressione arteriosa diastolica, che diviene un determinante principale del MVO2.
Gittata cardiaca
L'azione di pompa del cuore garantisce un continuo flusso di sangue, adeguato alle richieste metaboliche dell'organismo. Tale flusso è definito dalla gittata cardiaca. A riposo, in un individuo di corporatura media è:
Q=70 battiti/min*75ml, corrispondente a 5 litri/min
In condizioni di lavoro Q dovrà adeguarsi alle nuove richieste metaboliche. Ciò comporta un aumento sia della frequenza cardiaca sia della gittata ventricolare sistolica. Si giunge a valori di Q che, nel caso di esercizi massimali, possono superare i 35 litri/min. Si ritiene che la gittata cardiaca possa aumentare fino a un limite massimo variabile tra 3,5 e 5 volte il valore di riposo. Gli aumenti sono realizzati attraverso l'incremento, rispetto ai valori di riposo, di almeno 3 volte della frequenza cardiaca e di almeno 2 volte della gittata sistolica. Poiché Q dipende anche dalle dimensioni corporee dei soggetti considerati, si esprime in forma normalizzata per la superficie corporea si parla di indice cardiaco, che nel caso di un soggetto di media taglia è uguale, a riposo, a 2,78 l*min-1*m-2. Q può essere misurata con vari metodi. Quelli di diluizione si basano sull'assunto che la quantità di sangue che fluisce nel circolo polmonare sia uguale a quella che, nello stesso tempo, fluisce attraverso il circolo sistemico. Il metodo basato sul principio di Fick stabilisce che la velocità di trasporto di un soluto da parte di un fluido è uguale al prodotto della velocità di flusso del fluido per la concentrazione del soluto nel fluido stesso. Misurando a monte e a valle di un dato compartimento la concentrazione del soluto e conoscendo la velocità di flusso del fluido che attraversa il compartimento, è possibile calcolare la velocità di utilizzo, o di consumo, del soluto. L'applicazione pratica permette di misurare Q se si conoscono il consumo di O2 misurato alla bocca e i contenuti di ossigeno del sangue arterioso e di quello venoso misto. Il cuore è una pompa intermittente che espelle un certo volume di sangue in ciascun battito o ciclo cardiaco. Il volume di sangue che il cuore espelle in ciascun battito viene chiamato gittata sistolica, differenza tra il volume di sangue contenuto nel ventricolo alla fine della diastole (volume ventricolare telediastolico) e il volume di sangue che resta nel ventricolo alla fine della sistole. La gittata cardiaca è la somma di tutte le gittate sistoliche espulse dal ventricolo in un minuto. Conoscendo la gittata sistolica e la frequenza cardiaca, possiamo calcolare la gittata cardiaca nel modo seguente: GC=f*GS
rapporto tra gittata cardiaca e ritorno venoso quando la frequenza cardiaca e il volume di eiezione del ventricolo sx si mantengono costanti per un certo periodo, la gittata cardiaca e il ritorno venoso sono uguali. La funzione della pompa cardiaca è condizionata da parametri intrinseci alla pompa stessa, quali la frequenza di contrazione e lo stato inotropo del miocardio, ed estrinseci, quali il precarico condizionato dal ritorno venoso e dalla capacitanza del circolo venoso periferico, e il postcarico condizionato dalla resistenza del circolo arterioso periferico e dalla pressione arteriosa sistemica. Le grandi vene del torace e l'atrio dx costituiscono il deposito venoso centrale. A esso giunge il ritorno venoso e da esso origina la gittata cardiaca, stante la parità di flusso in entrata nell'atrio dx e in uscita dal ventricolo sx. La pressione del deposito venoso centrale può essere ritenuta prossima a zero. Il ritorno venoso è alimentato dal deposito venoso periferico. La pressione del sangue venoso contenuto nel deposito periferico è pari a 7mmHg. La caduta di pressione che si realizza tra il deposito periferico e l'atrio dx è sufficiente a sostenere il ritorno venoso e ciò in quanto la resistenza di questo tratto circolatorio è molto bassa.
Elettrocardiogramma
Rappresenta la registrazione a livello cutaneo dell'attività elettrica globale del cuore in funzione del tempo. È un esame economico, poco invasivo e permette di indagare in modo abbastanza efficace eventuali sofferenze patologiche. È reso possibile dal fatto che il nostro corpo fatto di H2O è un ottimo conduttore elettrico. Il cuore è sede di un'intensa attività elettrica, si tratta di un'attività che, originata nel nodo SA, si trasmette in modo coordinato a tutte le fibrocellule miocardiche che divengono sede di potenziali d'azione. Il triangolo di Einthoven è un triangolo equilatero, delimitato dalle due braccia e dall'arto inferiore sx, sui cui vertici sono posizionati tre elettrodi di registrazione. Il cuore occupa il centro di questo triangolo. L'impulso elettrico depolarizzante generato a livello del nodo SA percorre il cuore come un fronte d'onda perpendicolare all'asse cardiaco. Vengono interessati gli atri e in seguito il fronte d'onda raccolto dal nodo AV e convogliato attraverso il fascio di His alla massa ventricolare. L'asse cardiaco anatomico non è verticale, ma inclinato da dx verso sx. Su tale asse si proietta il vettore elettrico istantaneo che rappresenta la risultante della somma algebrica di tutti i potenziali d'azione e come tale è soggetto alle fluttuazioni cicliche e caratteristiche di tensione elettrica. Le informazioni più semplici che possono essere desunte dall'analisi del tracciato riguardano:
-frequenza cardiaca, ricavata dall'inverso del periodo misurato semplicemente come la distanza tra due onde R successive
-ritmicità dell'azione cardiaca, presenza di aritmie indicanti la presenza di eventuali blocchi
-morfologia del complesso QRS, in grado di dare informazioni sul trofismo della muscolatura ventricolare o di eventuali asincronismi di trasmissione dell'impulso elettrico ai due ventricoli
-presenza di battiti ventricolari prematuri (BVP) intercalati, con varia frequenza, tra i battiti normali
-presenza di livellamenti dei tratti isoelettrici, in particolare del tratto ST nell'infarto del miocardio
Le deflessioni che si riconoscono dal tracciato sono:
-onda P depolarizzazione degli atri
-onda Q depolarizzazione del setto interventricolare
-onda R depolarizzazione dell'apice e delle pareti ventricolari
-onda S depolarizzazione della base dei ventricoli
-complesso QRS depolarizzazione dei ventricoli
-onda T ripolarizzazione dei ventricoli
Gli intervalli dell'elettrocardiogramma sono:
-intervallo PR depolarizzazione atriale e conduzione attraverso il nodo AV
-durata di QRS depolarizzazione ventricolare
-intervallo QT depolarizzazione ventricolare e ripolarizzazione ventricolare
-intervallo ST (QT-QRS) ripolarizzazione ventricolare
Conduzione atrioventricolare accelerata o sindrome di Wolff-Parkinson-White è un quadro clinico caratterizzato da episodi di aritmia parossistica atriale causati da un ritorno dell'impulso dai ventricoli all'atrio dx attraverso un fascio anomalo di fibre miocardiche che si pone in parallelo con il fascio di His, altrimenti unica via di collegamento elettrico tra atri e ventricoli. Ne consegue la formazione di un percorso circolare, retrogrado, dell'impulso lungo una via costituita da: nodo SA, nodo AV, fascio di His, branca sx, fascio di Kent, nodo SA. Il fascio di Kent è suscettibile di ablazione chirurgica con ripristino della normale "anatomia elettrica" del cuore.
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2024